如图所示,在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变。则钠和氧化汞的物质的量之比是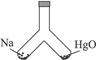
| A.1∶1 | B.2∶1 | C.23∶216.6 | D.216.6∶23 |
如图所示,在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变。则钠和氧化汞的物质的量之比是
| A.1∶1 | B.2∶1 | C.23∶216.6 | D.216.6∶23 |