(9分)在右图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极。接通电路后,发现B上的c点显红色。试回答: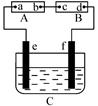
(1)电源A上的b为__________极。
(2)写出B上的电极反应式:
c_______________________;d_______________________。
(3)e、f电极上所产生的气体分别为__________、__________,其体积比为__________。
(9分)在右图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极。接通电路后,发现B上的c点显红色。试回答:
(1)电源A上的b为__________极。
(2)写出B上的电极反应式:
c_______________________;d_______________________。
(3)e、f电极上所产生的气体分别为__________、__________,其体积比为__________。