已知: 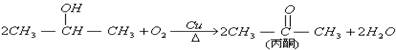
(丙酮不能发生银镜反应),现有如下转化关系: [F为高聚物,分子式为
[F为高聚物,分子式为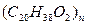 ]
]
请回答下列问题:
(1)反应类型:a ,b 。
(2)有机物A、D的结构简式:A ,D 。
(3)E→F的化学方程式 。
已知: 
(丙酮不能发生银镜反应),现有如下转化关系: [F为高聚物,分子式为
[F为高聚物,分子式为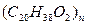 ]
]
请回答下列问题:
(1)反应类型:a ,b 。
(2)有机物A、D的结构简式:A ,D 。
(3)E→F的化学方程式 。