下面是苯和一组稠环芳香烃的结构式: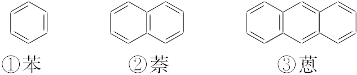

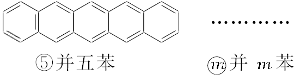
(1)写出化合物②—⑤的分子式:
①C6H6,②_________,③_________,④_________,⑤_________。
(2)这组化合物的分子式通式是C________H________(请以含m的表示式填在横线上,m=1,2,3,4,5…)。
(3)由于取代基的位置不同产生的异构现象,称为官能团位置异构。一氯并五苯有_________(填数字)个异构体;二氯蒽有_________(填数字)个异构体。
下面是苯和一组稠环芳香烃的结构式:


(1)写出化合物②—⑤的分子式:
①C6H6,②_________,③_________,④_________,⑤_________。
(2)这组化合物的分子式通式是C________H________(请以含m的表示式填在横线上,m=1,2,3,4,5…)。
(3)由于取代基的位置不同产生的异构现象,称为官能团位置异构。一氯并五苯有_________(填数字)个异构体;二氯蒽有_________(填数字)个异构体。