某种ABS工程树脂,由丙烯腈(CH2====CHCN,符号A)、1,3-丁二烯(CH2====CHCH====CH2,符号B)和苯乙烯(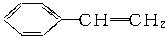 ,符号S)按一定配比共聚而得。
,符号S)按一定配比共聚而得。
(1)A、B和S三种单体,碳氢比(C∶H)值最小的单位体是______________。
(2)经元素分析可知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是______________(用a、b、c表示)。
某种ABS工程树脂,由丙烯腈(CH2====CHCN,符号A)、1,3-丁二烯(CH2====CHCH====CH2,符号B)和苯乙烯(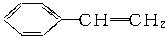 ,符号S)按一定配比共聚而得。
,符号S)按一定配比共聚而得。
(1)A、B和S三种单体,碳氢比(C∶H)值最小的单位体是______________。
(2)经元素分析可知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是______________(用a、b、c表示)。