(7分)现有下列高聚物:
A.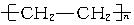 |
B.天然橡胶 | C.硫化橡胶 | D.用于制备电木的酚醛树脂 (E)有机玻璃,其中属于线型结构的是___________,属于体型结构的是___________,可溶于有机溶剂的是___________,加热能熔融的是___________,用于制备轮胎的是___________,用于制备车窗玻璃的是___________,用于制备插座、电器把手的是______________________。 |
(7分)现有下列高聚物:
A.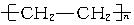 |
B.天然橡胶 | C.硫化橡胶 | D.用于制备电木的酚醛树脂 (E)有机玻璃,其中属于线型结构的是___________,属于体型结构的是___________,可溶于有机溶剂的是___________,加热能熔融的是___________,用于制备轮胎的是___________,用于制备车窗玻璃的是___________,用于制备插座、电器把手的是______________________。 |