过氧化氢H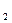 O
O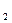 可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H
可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H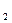 O
O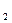 +H
+H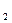 O
O
 +NH
+NH ↑。请完成下列问题:
↑。请完成下列问题:
(1)生成物A的化学式可表示为___________________________。
(2)该反应是氧化还原反应吗?____________。若是,则氧化剂是__________;若不是,请说明理由。
过氧化氢H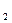 O
O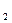 可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H
可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H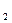 O
O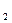 +H
+H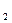 O
O
 +NH
+NH ↑。请完成下列问题:
↑。请完成下列问题:
(1)生成物A的化学式可表示为___________________________。
(2)该反应是氧化还原反应吗?____________。若是,则氧化剂是__________;若不是,请说明理由。