实验室用图2-16所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白。
(1)装置②中所盛溶液最好选用____________。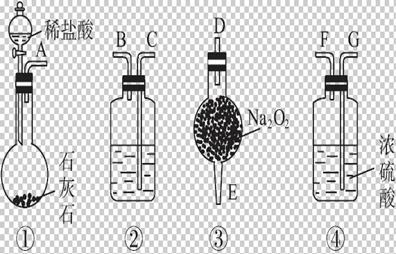
图2-16
A.饱和食盐水
B.饱和NaHCO3溶液
C.澄清石灰水
D.NaCl溶液
(2)如果将所制气体从左至右流向排列装置时,上述各仪器装置连接的正确顺序是(填写装置的编号)接接接,其中②③④之间的仪器接口按顺序应为(用接口标识A、B、C……填写)。
(3)装置②的作用是,发生反应的离子方程式是_______________。
实验室用图2-16所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白。
(1)装置②中所盛溶液最好选用____________。
图2-16
A.饱和食盐水
B.饱和NaHCO3溶液
C.澄清石灰水
D.NaCl溶液
(2)如果将所制气体从左至右流向排列装置时,上述各仪器装置连接的正确顺序是(填写装置的编号)接接接,其中②③④之间的仪器接口按顺序应为(用接口标识A、B、C……填写)。
(3)装置②的作用是,发生反应的离子方程式是_______________。