根据下图完成下列问题。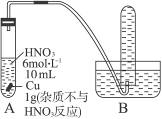
(1)A中发生反应的化学方程式:_______________________________________________。
(2)依次写出从反应开始到结束,A中可以观察到的现象:_________________________。
(3)反应结束后共收集到224 mL标准状况下的NO,计算Cu的纯度:_______________。
根据下图完成下列问题。
(1)A中发生反应的化学方程式:_______________________________________________。
(2)依次写出从反应开始到结束,A中可以观察到的现象:_________________________。
(3)反应结束后共收集到224 mL标准状况下的NO,计算Cu的纯度:_______________。