用如图所示装置进行实验。完成有关问题: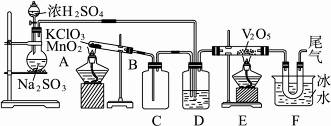
(1)玻璃管E内发生反应的化学方程式为________________。
(2)C的作用是________________。
(3)广口瓶D内盛的试剂是________,此装置的3个主要作用是________________。
(4)从试管E导出的气体成分是________________。
(5)装置F中U形管观察到所收集的物质的颜色状态是________________。
(6)该实验还缺少一个________装置。
用如图所示装置进行实验。完成有关问题:
(1)玻璃管E内发生反应的化学方程式为________________。
(2)C的作用是________________。
(3)广口瓶D内盛的试剂是________,此装置的3个主要作用是________________。
(4)从试管E导出的气体成分是________________。
(5)装置F中U形管观察到所收集的物质的颜色状态是________________。
(6)该实验还缺少一个________装置。