某溶液中可能含有Cl-、I-、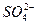 、
、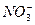 、
、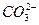 、
、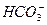 ,现进行如下实验:
,现进行如下实验:
(1)取部分溶液,加入过量Ba(NO3)2溶液,有白色沉淀生成,过滤出的沉淀部分溶于稀HNO3,并放出气体。
(2)取部分滤液,加入过量NaOH溶液,无沉淀产生。
(3)取部分滤液,加入AgNO3溶液,只有黄色沉淀生成。
根据上述现象,试判断:溶液中肯定存在的离子是____________,肯定不存在的离子是____________,可能存在的离子是____________。
某溶液中可能含有Cl-、I-、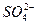 、
、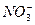 、
、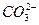 、
、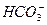 ,现进行如下实验:
,现进行如下实验:
(1)取部分溶液,加入过量Ba(NO3)2溶液,有白色沉淀生成,过滤出的沉淀部分溶于稀HNO3,并放出气体。
(2)取部分滤液,加入过量NaOH溶液,无沉淀产生。
(3)取部分滤液,加入AgNO3溶液,只有黄色沉淀生成。
根据上述现象,试判断:溶液中肯定存在的离子是____________,肯定不存在的离子是____________,可能存在的离子是____________。