在下图所示的转化关系中,已知B、D都是淡黄色固体,A与D反应生成离子化合物,完成下列问题。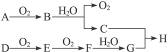
(1)写出下列物质的化学式:A.__________;F. __________;H. __________。
(2)写出C的电子式:____________________。
(3)写出B C,E
C,E F的化学方程式:___________________________________。
F的化学方程式:___________________________________。
在下图所示的转化关系中,已知B、D都是淡黄色固体,A与D反应生成离子化合物,完成下列问题。
(1)写出下列物质的化学式:A.__________;F. __________;H. __________。
(2)写出C的电子式:____________________。
(3)写出B C,E
C,E F的化学方程式:___________________________________。
F的化学方程式:___________________________________。