下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。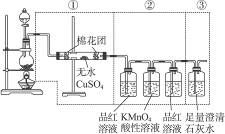
(1)如图将装置中①②③三部分仪器的连接顺序变为②①③,则可以检验出的物质是__________;不能检验出的物质是__________。
(2)如果将仪器的连接顺序变为①③②,则可以检验出的物质是__________;不能检验出的物质是__________。
(3)如果将仪器的连接顺序变为②③①,则可以检验出的物质是__________;不能检验出的物质是__________。
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。
(1)如图将装置中①②③三部分仪器的连接顺序变为②①③,则可以检验出的物质是__________;不能检验出的物质是__________。
(2)如果将仪器的连接顺序变为①③②,则可以检验出的物质是__________;不能检验出的物质是__________。
(3)如果将仪器的连接顺序变为②③①,则可以检验出的物质是__________;不能检验出的物质是__________。