从某物质A的水溶液出发有下图所示的一系列变化: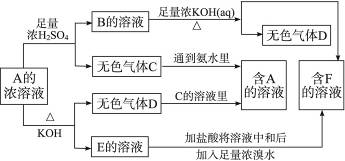
试完成下列问题:
(1)物质的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
(2)写出EF的离子方程式________________________。
(3)鉴定物质F的方法________________________。
从某物质A的水溶液出发有下图所示的一系列变化:
试完成下列问题:
(1)物质的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
(2)写出EF的离子方程式________________________。
(3)鉴定物质F的方法________________________。