下列实验事实或实验现象,反映了硫酸的哪些性质?
(1)在工业上可用铁槽车或铝槽车运输浓硫酸_________________________________。
(2)浓硫酸与甲酸共热可制备一氧化碳_______________________________________。
(3)实验室用锌粒和稀H2SO4反应制备氢气___________________________________。
(4)浓硫酸露置在空气中质量增加____________________________________________。
(5)浓硫酸和食盐反应可生成NaHSO4和Na2SO4两种盐_____________________________。

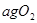 同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为
同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为 ,高温下容器中木炭与
,高温下容器中木炭与 均完全反应后恢复到原温度,压力表的示数为
均完全反应后恢复到原温度,压力表的示数为 ,试求:
,试求:
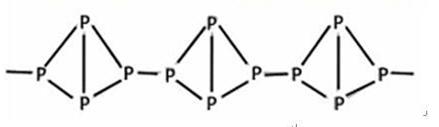 ,
, 粤公网安备 44130202000953号
粤公网安备 44130202000953号