侯氏制碱法的步骤如下图所示: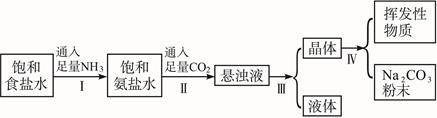
试完成下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合物,则I和Ⅱ的总反应式是________________。
(2)由这一反应可知NaCl比NaHCO3溶解度________________。
(3)操作I、Ⅱ不能颠倒的原因是 ________________。
(4)Ⅲ的操作叫 ________________;Ⅳ的操作叫 ________________________。
侯氏制碱法的步骤如下图所示:
试完成下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合物,则I和Ⅱ的总反应式是________________。
(2)由这一反应可知NaCl比NaHCO3溶解度________________。
(3)操作I、Ⅱ不能颠倒的原因是 ________________。
(4)Ⅲ的操作叫 ________________;Ⅳ的操作叫 ________________________。