在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用如图42所示的工艺流程生成单质碘。
完成下列问题:
(1)写出乙、丁中溶质的化学式:乙______________,丁______________。
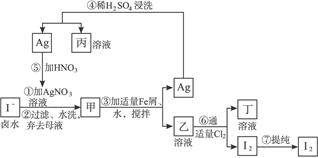
图4-2
(2)第④步操作中用稀H2SO4浸洗的目的是( )
A.除去未反应的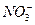 |
B.除去未反应的I- |
| C.除去未反应的Fe | D.除去碱性物质 |
(3)第⑦步操作可供提纯I2的一种方法是__________________________(只填名称)。
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用如图42所示的工艺流程生成单质碘。
完成下列问题:
(1)写出乙、丁中溶质的化学式:乙______________,丁______________。

图4-2
(2)第④步操作中用稀H2SO4浸洗的目的是( )
A.除去未反应的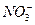 |
B.除去未反应的I- |
| C.除去未反应的Fe | D.除去碱性物质 |
(3)第⑦步操作可供提纯I2的一种方法是__________________________(只填名称)。