酸性氧化物和碱性氧化物相互作用可生成含氧酸盐,而硫代硫酸盐可由酸性的非金属硫化物与碱性的金属硫化物作用制得。
如:3Na2S+As2S3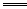 2Na3AsS3(硫代亚砷酸钠),试写出下列反应的化学方程式:
2Na3AsS3(硫代亚砷酸钠),试写出下列反应的化学方程式:
(1)Na2S与As2S5反应: 。
(2)CaS与As2S3反应: 。
(3)As2S3和As2O3相似,具有还原性,Na2S2和Na2O2相似,具有氧化性,则As2S3与Na2S2作用的化学方程式为 。
 雨、灰霾和光化学烟雾等区域性大气污染突出,严重威胁
雨、灰霾和光化学烟雾等区域性大气污染突出,严重威胁 车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等到物质,这种尾气越来越成
车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等到物质,这种尾气越来越成 ,
, 无毒气体。同温同压下,7LNH3恰好将6LNO
无毒气体。同温同压下,7LNH3恰好将6LNO 粤公网安备 44130202000953号
粤公网安备 44130202000953号