不同卤素的原子互相可以共用电子对形成一系列化合物,这类化合物叫卤素互化物,现将4.66 g BrCln溶于水,再通入过量SO2,使其发生如下反应:BrCln+(n+1)H2O+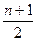 SO2====HBr+nHCl+
SO2====HBr+nHCl+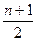 H2SO4
H2SO4
待反应完全后将所得溶液调至中性,再加入过量Ba(NO3)2溶液可生成11.65 g沉淀,试确定BrCln中的n值。
不同卤素的原子互相可以共用电子对形成一系列化合物,这类化合物叫卤素互化物,现将4.66 g BrCln溶于水,再通入过量SO2,使其发生如下反应:BrCln+(n+1)H2O+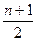 SO2====HBr+nHCl+
SO2====HBr+nHCl+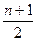 H2SO4
H2SO4
待反应完全后将所得溶液调至中性,再加入过量Ba(NO3)2溶液可生成11.65 g沉淀,试确定BrCln中的n值。