已知CN- (氰根离子)、SCN- (硫氰酸根离子)和Cl-有相似之处:两个CN原子团或两个SCN原子团可分别构成氰分子(CN)2和硫氰分子(SCN)2。(CN)2和(SCN)2的性质与Cl2的性质有相似之处,且常温、常压下是气体。写出下列反应的化学方程式:
(1)MnO2和HSCN溶液加热反应___________________________________。
(2)(CN)2和KOH溶液反应________________________________________。
(3)(SCN)2和AgNO3溶液反应______________________________________。
 依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
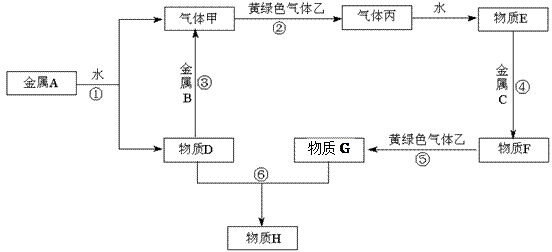
 加入过量的稀盐酸,有白色沉淀生成。
加入过量的稀盐酸,有白色沉淀生成。 纸变蓝色的气体。
纸变蓝色的气体。 一定含有、NO3-离子,一定不含有离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程),。
一定含有、NO3-离子,一定不含有离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程),。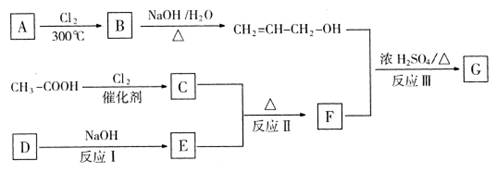

 粤公网安备 44130202000953号
粤公网安备 44130202000953号