某温度下0.1 mol·L-1Na2CO3溶液中,c(Na+)/c(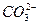 )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(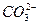 )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c( )=_________。
)=_________。
某温度下0.1 mol·L-1Na2CO3溶液中,c(Na+)/c(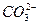 )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(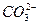 )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c( )=_________。
)=_________。