)根据下图所示的能量变化,写出下列反应的热化学方程式并回答相关问题:
(1)____________________________________________________________________;
(2)____________________________________________________________________。
Q1与Q2的关系:Q1____________(填“大于”“小于”或“等于”)Q2。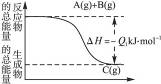
反应过程(1)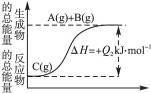
反应过程(2)
)根据下图所示的能量变化,写出下列反应的热化学方程式并回答相关问题:
(1)____________________________________________________________________;
(2)____________________________________________________________________。
Q1与Q2的关系:Q1____________(填“大于”“小于”或“等于”)Q2。
反应过程(1)
反应过程(2)