化合物A、D、F是中学化学中常见的化合物,B、C、E中含有两种相同的元素,这些化合物之间存在如下关系,其中A和B的反应是一种重要化工生产中的主要反应。据此判断:
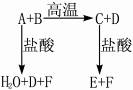
(1)化合物A、C、F含有的相同的元素是 。
(2)化合物C化学式为 ,化合物A的水溶液显 性。
(3)C的水溶液和D的水溶液能否发生反应?理由是什么?
化合物A、D、F是中学化学中常见的化合物,B、C、E中含有两种相同的元素,这些化合物之间存在如下关系,其中A和B的反应是一种重要化工生产中的主要反应。据此判断:

(1)化合物A、C、F含有的相同的元素是 。
(2)化合物C化学式为 ,化合物A的水溶液显 性。
(3)C的水溶液和D的水溶液能否发生反应?理由是什么?