2014年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是: 2CO2(g)+6H2(g)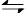 CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。
①写出该反应的平衡常数表达式。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是。
| A.容器中密度不变 |
| B.单位时间内消耗2molCO2,同时消耗1mol二甲醚 |
| C.v(CO2)︰v(H2)=1︰3 |
| D.容器内压强保持不变 |
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) 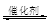 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
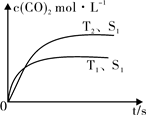
① 该反应的ΔH0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g)+2H2(g) CH3OH(g) rH =" -a" kJ•mol-1。
CH3OH(g) rH =" -a" kJ•mol-1。
①经测定不同温度下该反应的平衡常数如下:
温度(℃)
|
250
|
300
|
350
|
K
|
2.041
|
0.270
|
0.012
|
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1,则此时v正v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min)
|
5
|
10
|
15
|
20
|
25
|
30
|
压强比(P后/P前)
|
0.98
|
0.90
|
0.80
|
0.70
|
0.70
|
0.70
|
达到平衡时CO的转化率为。
 N2O4(g)
N2O4(g)
 N2O4(g)
N2O4(g)