根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫色;
②向FeCl2溶液中加入氯水,再加入KSCN溶液,呈红色;
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去。
A.I2>Cl2>Fe3+>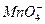 |
B.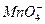 >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
C.Cl2>I2>Fe3+>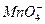 |
D.Fe3+>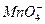 >Cl2>I2 >Cl2>I2 |
根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫色;
②向FeCl2溶液中加入氯水,再加入KSCN溶液,呈红色;
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去。
A.I2>Cl2>Fe3+>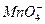 |
B.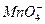 >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
C.Cl2>I2>Fe3+>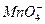 |
D.Fe3+>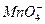 >Cl2>I2 >Cl2>I2 |