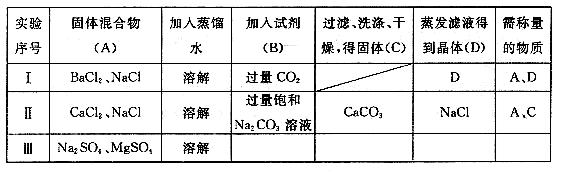
试回答下列问题:
(1)实验Ⅰ中D 的成分是___________称量后_________(填“能”或“不能”)通过计算得到A中各组分的质量比.
(2)实验II 填写的内容中明显错误的是________,其原因________________________
(3)对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内,最终能得出A中各组分的质量比为:(用含字母的表达式表示)____________________________

试回答下列问题:
(1)实验Ⅰ中D 的成分是___________称量后_________(填“能”或“不能”)通过计算得到A中各组分的质量比.
(2)实验II 填写的内容中明显错误的是________,其原因________________________
(3)对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内,最终能得出A中各组分的质量比为:(用含字母的表达式表示)____________________________