下面是一个四肽,它可以看作是4个氨基酸缩合掉3个分子水而得。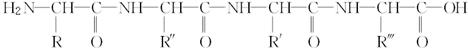
式中,R,R′,R″,R可能是相同的或不同的烃基,或有取代基的烃基;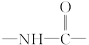 称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸: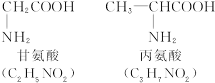
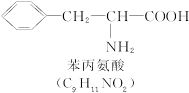
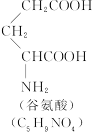
(1)这个“多肽”是___________肽。
(2)该1 mol多肽水解后,有___________mol谷氨酸。
(3)该1 mol多肽水解后,有___________mol苯丙氨酸。
下面是一个四肽,它可以看作是4个氨基酸缩合掉3个分子水而得。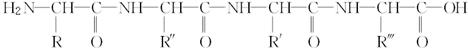
式中,R,R′,R″,R可能是相同的或不同的烃基,或有取代基的烃基;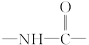 称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸: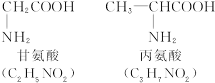


(1)这个“多肽”是___________肽。
(2)该1 mol多肽水解后,有___________mol谷氨酸。
(3)该1 mol多肽水解后,有___________mol苯丙氨酸。