有一新型抗癌药,其分子式为C47H51NO14,它是由如下的酸A和醇反应而生成的一种酯。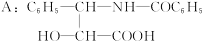
B.R—OH(R是一个含C、H、O的基团)
(1)A在无机酸催化下可水解,其反应方程式为______________________________。
(2)A水解所得到的产物是否是天然蛋白质水解产物?__________,原因是______________。
(3)写出ROH的分子式__________。
有一新型抗癌药,其分子式为C47H51NO14,它是由如下的酸A和醇反应而生成的一种酯。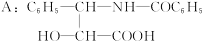
B.R—OH(R是一个含C、H、O的基团)
(1)A在无机酸催化下可水解,其反应方程式为______________________________。
(2)A水解所得到的产物是否是天然蛋白质水解产物?__________,原因是______________。
(3)写出ROH的分子式__________。