聚四氟乙烯的耐热性和化学稳定性都超过了其他合成材料,号称“塑料王”。在工业生产上有广泛的应用,其合成路线如下: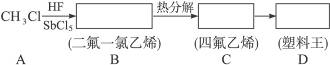
试完成下列各题:
(1)在直方框内填写有机物的结构简式。
(2)写出下列反应的化学方程式:
B→C:__________________________________________________________________;
C→D:__________________________________________________________________。
聚四氟乙烯的耐热性和化学稳定性都超过了其他合成材料,号称“塑料王”。在工业生产上有广泛的应用,其合成路线如下:
试完成下列各题:
(1)在直方框内填写有机物的结构简式。
(2)写出下列反应的化学方程式:
B→C:__________________________________________________________________;
C→D:__________________________________________________________________。