A、B、C、D为四种由短周期元素形成的化合物,它们的焰色反应均为黄色,并有下列转化关系。A中既含有离子键又含有非极性共价键,D含四种元素。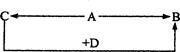
(1)A的电子式是 。
(2)把1 molCO2通入含2 molC的溶液后,溶液中各离子浓度由大到小的顺序是 。
(3)1 molA与2 molD固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体是 (用化学式表示)。
A、B、C、D为四种由短周期元素形成的化合物,它们的焰色反应均为黄色,并有下列转化关系。A中既含有离子键又含有非极性共价键,D含四种元素。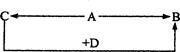
(1)A的电子式是 。
(2)把1 molCO2通入含2 molC的溶液后,溶液中各离子浓度由大到小的顺序是 。
(3)1 molA与2 molD固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体是 (用化学式表示)。