A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、A3+、Fe3+和阴离子OH-、 、
、 、
、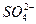 两两组合而成,它们的溶液发生如下反应:
两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。C与D反应生成有色沉淀。B与C反应生成白色沉淀。写出它们的化学式:
A:_____________,B:_____________,C:_____________D:_____________。
A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、A3+、Fe3+和阴离子OH-、 、
、 、
、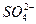 两两组合而成,它们的溶液发生如下反应:
两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。C与D反应生成有色沉淀。B与C反应生成白色沉淀。写出它们的化学式:
A:_____________,B:_____________,C:_____________D:_____________。