【10分】甲、乙、丙、丁和戊五种溶液,分别由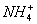 、K+、Al3+、Ag+、Ba2+和Cl-、Br-、
、K+、Al3+、Ag+、Ba2+和Cl-、Br-、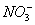 、
、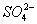 、
、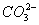 中的一种组成(离子不重复出现)。其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。根据上述事实推断上述溶液中溶质的化学式。
中的一种组成(离子不重复出现)。其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。根据上述事实推断上述溶液中溶质的化学式。
甲___________,乙___________,丙___________,丁___________,戊___________。
【10分】甲、乙、丙、丁和戊五种溶液,分别由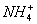 、K+、Al3+、Ag+、Ba2+和Cl-、Br-、
、K+、Al3+、Ag+、Ba2+和Cl-、Br-、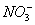 、
、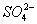 、
、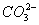 中的一种组成(离子不重复出现)。其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。根据上述事实推断上述溶液中溶质的化学式。
中的一种组成(离子不重复出现)。其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。根据上述事实推断上述溶液中溶质的化学式。
甲___________,乙___________,丙___________,丁___________,戊___________。