如图所示水槽中试管内有一枚铁钉,放置数天观察: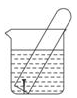
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于____________腐蚀。
(2)若试管内液面上升,则原溶液是____________性,发生____________腐蚀,电极反应:负极:____________,正极____________。
(3)若试管内液面下降,则原溶液呈____________,发生____________腐蚀,电极反应:负极____________,正极____________。
如图所示水槽中试管内有一枚铁钉,放置数天观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于____________腐蚀。
(2)若试管内液面上升,则原溶液是____________性,发生____________腐蚀,电极反应:负极:____________,正极____________。
(3)若试管内液面下降,则原溶液呈____________,发生____________腐蚀,电极反应:负极____________,正极____________。