测定水中溶液氧气的方法是:取a mL水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用Na2S2O3溶液(浓度b mol/L)和I2反应,消耗了VmL达到终点(以淀粉作指示剂)。有关方程式为:①2Mn2++O2+4OH-=2MnO(OH)2(反应很快);②MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;③I2+2S2O32-=S4O62-+2I-。
⑴需要进行滴定的反应是 ,终点的颜色变化为 。
⑵将Na2S2O3溶液盛放在 (“酸式”或“碱式”)滴定管中。
⑶在加入MnSO4溶液及含有NaOH的KI溶液和适量的稀硫酸时,要迅速的加入,否则将对结果造成 (“偏高”、“偏低”或“无影响”),原因是
。
⑷在加入MnSO4溶液及含有NaOH的KI溶液振荡时,塞子未塞紧,溅出部分溶液,则将对结果造成 (“偏高”、“偏低”或“无影响”),原因是
。
⑸水中溶液O2为(以m g/L为单位) 。

 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)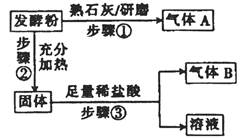


 粤公网安备 44130202000953号
粤公网安备 44130202000953号