铜及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)高温煅烧时CuS发生的反应为:____CuS+____NaCl+____ O2→____CuCl2+ _____Na2SO4,配平该反应方程式。
(2)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
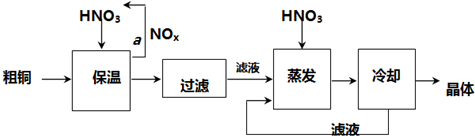
①在步骤a中,还需要通入氧气和水,其目的是________________;
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在___________范围;
|
氢氧化物开始沉淀时的pH
|
氢氧化物沉淀完全时的pH
|
Fe3+
|
1.9
|
3.2
|
Cu2+
|
4.7
|
6.7
|
不用加水的方法调节溶液pH的原因是________________;
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是____________(结合离子方程式说明)。
(3)通过下述图1装置可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。
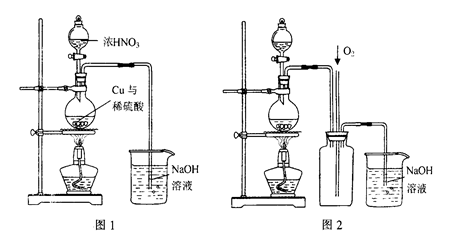
烧瓶内发生反应的离子方程式为____________________________________________;图2是图1的改进装置,其优点有①__________________________,②_________________________。
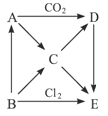
(4)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图所示

对图中a点的说法正确的是 (填序号)。
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上。
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的C(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和