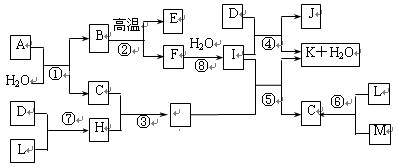
硫酸工业生产应考虑综合经济效益问题。
(1)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105 kJ的热量。请通过计算判断,若反应SO2(g)+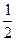 O2(g)
O2(g) SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
(2)CuFeS2是黄铁矿的另一成分,燃烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度的不同而变化(见下表)。
| 沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
| 矿渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660 ℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
 两容积相等的密闭容器。
两容积相等的密闭容器。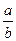 ________
________ 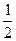 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。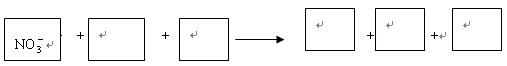
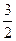 C(s)=
C(s)=  ,可得沉淀质量与消耗的盐酸体积关系如右图:
,可得沉淀质量与消耗的盐酸体积关系如右图: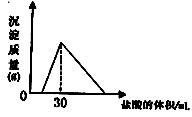

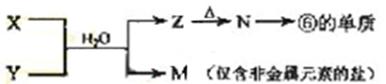
 物中,R呈现最高化合价的化合物的化学式是;
物中,R呈现最高化合价的化合物的化学式是; 种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是。
种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是。 极为丰富的元素。
极为丰富的元素。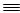 N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。
N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。 (白圆圈代表N3-离子)
(白圆圈代表N3-离子)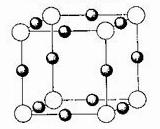
 粤公网安备 44130202000953号
粤公网安备 44130202000953号