反应2SO2(g)+O2(g)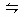 2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。
2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。
反应2SO2(g)+O2(g)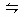 2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。
2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。