| A.向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO  +2OH-===CaCO3↓+2H2O+CO +2OH-===CaCO3↓+2H2O+CO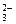 |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合 Ba2++2OH-+NH  +HCO +HCO ===BaCO3↓+NH3·H2O+H2O ===BaCO3↓+NH3·H2O+H2O |
| C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+===Al3++3H2O |
| D.过量CO2通入氢氧化钠溶液中 |
CO2+2OH-===CO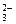 +H2O
+H2O
| A.向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO  +2OH-===CaCO3↓+2H2O+CO +2OH-===CaCO3↓+2H2O+CO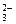 |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合 Ba2++2OH-+NH  +HCO +HCO ===BaCO3↓+NH3·H2O+H2O ===BaCO3↓+NH3·H2O+H2O |
| C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+===Al3++3H2O |
| D.过量CO2通入氢氧化钠溶液中 |
CO2+2OH-===CO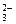 +H2O
+H2O