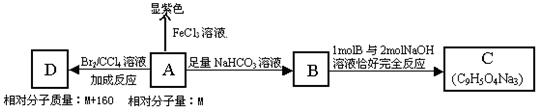
下列A ~ I九种物质之间的转化关系如图所示;其中部分生成物或反应条件已略去。已知A为固态单质,常温下C、E、F都是无色气体。
请填空:
(1)C的固体属于_____晶体,F的化学式(分子式)是________。
(2)A与B反应的化学方程式是: 。
(3)G与H反应的离子方程式是 ,
E转变为H和I的离子方程式是 。


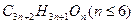 ,则杜鹃素的分为。
,则杜鹃素的分为。 ,则杜鹃素分子中一Y的名称为。
,则杜鹃素分子中一Y的名称为。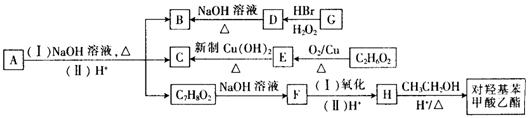
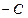 H
H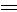 CH2+HBr
CH2+HBr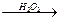 CH3CH2CH2Br
CH3CH2CH2Br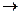 B的化学方程式为
B的化学方程式为 。
。 构体有种(对羟基苯甲酸乙酯自身除外)。
构体有种(对羟基苯甲酸乙酯自身除外)。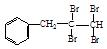 与NaOH的水溶液共热的化学方程式为:;
与NaOH的水溶液共热的化学方程式为:;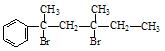 与NaOH的醇溶液共热可以生成种稳定的二烯烃。
与NaOH的醇溶液共热可以生成种稳定的二烯烃。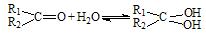 ;这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构。若
;这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构。若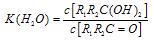 为醛酮的水合平衡常数,其值越大则对应的醛酮水合物越稳定。下表是部分醛、酮的水合平衡常数:
为醛酮的水合平衡常数,其值越大则对应的醛酮水合物越稳定。下表是部分醛、酮的水合平衡常数:

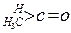
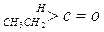
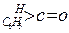
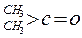

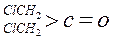

 有以下两种方法:
有以下两种方法:

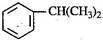 ),是一种重要的有机化工原料。
),是一种重要的有机化工原料。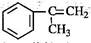 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)。
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)。
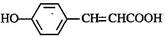 的邻位异构体分子内脱水产物香豆素的结构简式 。
的邻位异构体分子内脱水产物香豆素的结构简式 。 )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。 粤公网安备 44130202000953号
粤公网安备 44130202000953号