 有关物质存在如图所示的转化关系(部分产物已省略)。通常为气体单质,为紫黑色固体单质。实验室中,常用固体在的催化下加热制取气体单质。
有关物质存在如图所示的转化关系(部分产物已省略)。通常为气体单质,为紫黑色固体单质。实验室中,常用固体在的催化下加热制取气体单质。


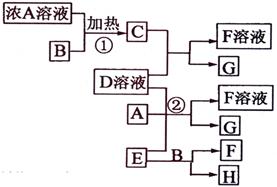

 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取的化学方程式
 (4)溶液与溶液混合可形成沉淀,此沉淀的=7.0×10-9。将等体积的溶液与溶液混合,若的浓度为1×10-2 ,则生成沉淀所需溶液的最小浓度为。
(4)溶液与溶液混合可形成沉淀,此沉淀的=7.0×10-9。将等体积的溶液与溶液混合,若的浓度为1×10-2 ,则生成沉淀所需溶液的最小浓度为。
 有关物质存在如图所示的转化关系(部分产物已省略)。通常为气体单质,为紫黑色固体单质。实验室中,常用固体在的催化下加热制取气体单质。
有关物质存在如图所示的转化关系(部分产物已省略)。通常为气体单质,为紫黑色固体单质。实验室中,常用固体在的催化下加热制取气体单质。




 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取的化学方程式
 (4)溶液与溶液混合可形成沉淀,此沉淀的=7.0×10-9。将等体积的溶液与溶液混合,若的浓度为1×10-2 ,则生成沉淀所需溶液的最小浓度为。
(4)溶液与溶液混合可形成沉淀,此沉淀的=7.0×10-9。将等体积的溶液与溶液混合,若的浓度为1×10-2 ,则生成沉淀所需溶液的最小浓度为。