某待测液可能有Fe2+、Fe3+、Ag+、Ba2+、Al3+、Ca2+、NH4+等离子,进行了下述实验(所加酸、碱、NH3水、Br2水都是过量的)。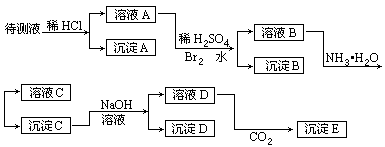
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子,并写出理由。答_________。
(2)写出化学式:沉淀A_________;沉淀D_________;沉淀E_________。
(3)写出下列离子反应方程式:
溴水氧化溶液A中的某离子:_________。
沉淀C加入足量NaOH溶液后其中一种沉淀溶解:_________。
某待测液可能有Fe2+、Fe3+、Ag+、Ba2+、Al3+、Ca2+、NH4+等离子,进行了下述实验(所加酸、碱、NH3水、Br2水都是过量的)。
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子,并写出理由。答_________。
(2)写出化学式:沉淀A_________;沉淀D_________;沉淀E_________。
(3)写出下列离子反应方程式:
溴水氧化溶液A中的某离子:_________。
沉淀C加入足量NaOH溶液后其中一种沉淀溶解:_________。