河南省汝州市高二上学期第一次月考化学试卷
下列反应中生成物总能量高于反应物总能量的是 ( )
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
在2A+B 3C+4D中,表示该反应速率最快的是 ( )
3C+4D中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol/(L·s) B.v(B)=0.3 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·s)
下列热化学方程式书写正确的是 ( )
| A.C(s)+O2(g)==CO2(g);△H=+393.5kJ/mol |
| B.2SO2+O2==2SO3;△H= —196.6kJ/mol |
| C.H2(g)+1/2O2(g)==H2O(l);△H=—285.8kJ/mol |
| D.2H2(g)+O2(g)==2H2O(l);△H= —571.6KJ |
下列表述中正确的是 ( )
| A.任何能使熵值增大的过程都能自发进行 |
B.已知热化学方程式2SO2(g)+O2(g) 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 |
| C.化学平衡发生移动,平衡常数一定发生变化 |
| D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |
将1 mol SO2和1 mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量( )
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量( )
| A.等于0.3 mol | B.等于0.15 mol |
| C.小于0.15 mol | D.大于0.15 mol,小于0.3 mol |
以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=-Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=-Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是 ( )
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
| A.降低温度 |
| B.增大压强同时加催化剂 |
| C.升高温度同时充入N2 |
| D.及时将CO2和N2从反应体系中移走 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) === SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) === SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) === S(正交,s) △H3
下列说法正确的是( )
| A.△H3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)===S(正交,s) △H3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)===S(正交,s) △H3>0,单斜硫比正交硫稳定 |
在一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生反应:
2SO2(g)+O2(g) 2SO3(g),平衡后改变下列条件,SO3平衡浓度不改变的是( )
2SO3(g),平衡后改变下列条件,SO3平衡浓度不改变的是( )
| A.保持温度和容器体积不变,充入1 mol SO3(g) |
| B.保持温度和容器内压强不变,充入1 mol SO3(g) |
| C.保持温度和容器内压强不变,充入1 mol O2(g) |
| D.保持温度和容器内压强不变,充入1 mol Ar(g) |
反应:xA(g)+yB(g) zC(g),达到平衡时测得A气体的浓度为0.5 mol·L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g),达到平衡时测得A气体的浓度为0.5 mol·L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol·L-1,则下列叙述正确的是
| A.x+y<z | B.平衡向右移动 |
| C.B的转化率升高 | D.C的体积分数降低 |
恒容密闭容器中进行的可逆反应2NO2 2NO+O2,可作为达到平衡状态的标志是( )
2NO+O2,可作为达到平衡状态的标志是( )
①单位时间内生成a mo1 O2的同时生成2a mol NO2
②单位时间内生成a mol O2的同时生成2a molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
| A.①③⑤ | B.②④⑤ | C.①③④ | D.①②③④⑤ |
下列事实,不能用勒夏特列原理解释的是 ( )
A.溴水中有下列平衡:Br2+H2O HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅 HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对2HI(g)  H2(g)+I2(g),平衡体系增大压强可使颜色变深 H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
C.反应CO+NO2  CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
D.合成NH3反应,为提高NH3的产率,应采取低温度的措施(N2+3H2 2NH3;△H<0) 2NH3;△H<0) |
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是 ( )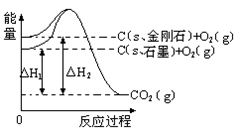
| A.C(s、石墨)==C(s、金刚石)△H=" +1.9" kJ•mol-1 |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
在25℃、101KPa下,1g甲醇燃烧生成CO2和液态水时放热22.68KJ,
下列热化学方程正确的是 ( )
A.CH3OH(l)+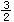 O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452KJ/mol |
C.CH3OH(l)+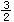 O2(g)=CO2(g)+2H2O(g) ΔH="-725.8KJ/mol" O2(g)=CO2(g)+2H2O(g) ΔH="-725.8KJ/mol" |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1452KJ/mol |
在一定条件下,向2 L密闭容器中充入3 mol X(g)和1 mol Y(g)进行反应:
2X(g)+Y(g) 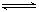 3Z(g)+2W(g),某时刻测定产物的浓度,不可能的是( )
3Z(g)+2W(g),某时刻测定产物的浓度,不可能的是( )
| A.Z=0.75 mol / L | B.Z=1 mol / L |
| C.W=1 mol / L | D.W=0.8 mol / L |
下列反应中符合图像的是 ( )
A.N2(g)+3H2(g) 2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3(g) 2SO2(g)+O2(g)ΔH>0 2SO2(g)+O2(g)ΔH>0 |
C.4NH3(g)+5O2(g)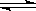 4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
D.H2(g)+CO(g)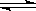 C(s)+H2O(g) ΔH>0 C(s)+H2O(g) ΔH>0 |
对于化学反应能否自发进行,下列说法中错误的是 ( )
| A.若ΔH<0,△S>0,任何温度下都能自发进行 |
| B.若ΔH>0,△S<0,任何温度下都不能自发进行 |
| C.若ΔH>0,△S>0,低温时可自发进行 |
| D.若ΔH<0,△S<0,低温时可自发进行 |
已知下列热化学方程式:①H2(g) +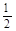 O2(g) =H2O(l);ΔH="-285" kJ·mol-1
O2(g) =H2O(l);ΔH="-285" kJ·mol-1
②H2(g) +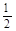 O2(g) =H2O(g);ΔH="-241.8" kJ·mol-1
O2(g) =H2O(g);ΔH="-241.8" kJ·mol-1
③C(s) + O2(g) =CO(g);ΔH="-110.5" kJ·mol-1
O2(g) =CO(g);ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g) =CO2(g);ΔH="-393.5" kJ·mol-1
回答下列问题:
(1)H2的燃烧热为 C的燃烧热为 。
(2)燃烧10gH2生成液态水,放出的热量为 。
(3)写出CO燃烧的热化学方程式 。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: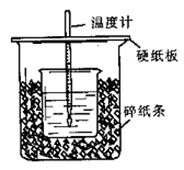
(1)从实验装置上看,图中尚缺少的一种玻璃用品
是 。烧杯间填满碎纸条的作用是 。
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“偏大、偏小、相等”),所求中和热 (填“偏大、偏小、相等”)
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
对于可逆反应:2A(g)+3B(g)  xC(g)+D(g),已知A和B的起始浓度分别为5mol·L-1和3mol·L-1,反应开始到达平衡的时间是2 min,C的反应速率为0.5mol·L-1·min-1,平衡时D的浓度为0.5mol·L-1。求:
xC(g)+D(g),已知A和B的起始浓度分别为5mol·L-1和3mol·L-1,反应开始到达平衡的时间是2 min,C的反应速率为0.5mol·L-1·min-1,平衡时D的浓度为0.5mol·L-1。求:
(1)x=
(2)B的平衡浓度为
(3)该反应平衡常数为 。(只要求写数值且保留一位有效数字)
某化学反应2A(g)  B(g)+D(g)在三种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在三种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 |
  时间 时间浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
(1)在实验1,反应在10至20分钟时间内用A表示表示该反应的平均速率为_______
(2)在实验2,A的初始浓度c2=____mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)比较实验3和1,则正反应是____反应(填吸热、放热),理由是___________________
已知NO2和N2O4可以相互转化:N2O4(g) 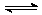 2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
(1)图中共有两条曲线X和Y,其中表示N2O4浓度 随时间变化的曲线是_________
(2)前10min内,v(N2O4)= ______________ ;
(3)a、b、c、d四个点中,表示化学反应处于平衡状态的是____,此时反应的平衡常数为______________(只要求写数值)
(4)反应进行到25min时,曲线发生变化的原因是____________________________;
若要达到最后相同的化学平衡状态,在25min时还可以采取的措施是( )(双选)
| A.升高温度 | B.缩小容器体积 | C.加入催化剂 | D.加入一定量的N2O4 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号