云南省云龙县高二下学期期末考试化学试卷
化学与人类生活、社会可持续发展密切相关。下列有关说法正确的是
①高空臭氧层吸收太阳紫外线,保护地球生物;低空臭氧是污染气体,对人体有危害
②为防止电池中的重金属污染,废旧电池应作深埋处理
③PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重
④易降解的生物农药更适合于在未来有害生物综合治理中的应用
⑤回收制革工厂的边角皮料生产食用明胶,加工成医用胶囊或做食品增稠剂
| A.①②⑤ | B.①③④ | C.②④⑤ | D.①③⑤ |
下列化学用语使用正确的是
① CH4 分子的球棍模型: ②次氯酸的电子式
②次氯酸的电子式 
③CO2分子的结构式:O==C==O ④聚氯乙烯的单体结构简式为CH2==CHCl
⑤葡萄糖的最简式(实验式):CH2O
| A.①④⑤ | B.②③④ | C.②④⑤ | D.③④⑤ |
下列有关常见有机物的说法正确的是
| A.蛋白质、纤维素、蔗糖、天然橡胶都是高分子化合物 |
| B.甲烷、乙烯、甲苯分子中所有原子都在同一平面上 |
| C.乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
| D.乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 |
有机物X、Y、M(M为乙酸)的转化关系为: ,下列说法错误的是
,下列说法错误的是
| A.X可用新制的氢氧化铜检验 |
| B.反应X→Y中,1molX可生成3molY |
| C.由Y生成乙酸乙酯的反应属于取代反应 |
| D.可用碘的四氯化碳溶液检验淀粉是否水解完全 |
下列溶液中离子可以大量共存的是
| A.常温下c(H+)/c(OH-)= 1×10-12的溶液:NH4+、Ca2+、C1-、K+ |
| B.加Zn能放出H2的溶液:Mg2+、SO42-、Cl- 、HCO3- |
| C.含有较多Fe3+的溶液:Na+、H+、Cl-、SO42- |
| D.滴入KSCN溶液呈红色的溶液:K+、Na+、SO42-、CO32- |
用NA表示阿伏加德罗常数,下列说法中正确的是
| A.足量的Cu与含有0.2mol H2SO4的浓硫酸共热可生成SO2为0.1NA |
| B.78 g苯含有碳碳双键的数目为3NA |
| C.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.1NA |
| D.25℃,1LpH=1的硫酸溶液中含有的H+数目为0.2NA |
A是一种常见单质,B、C为常见化合物,A、B、C均含有元素X,它们有如下图的转化关系(部分产物及反应条件已略去)。下列判断正确的是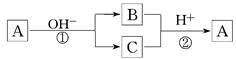
A.X元素可能为Al
B.X元素一定为金属元素
C.反应①和②一定互为可逆反应
D.反应①和②一定为氧化还原反应
下列有关能量的判断或表示方法正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| B.从C(石墨)=C(金刚石)△H=+1.9kJ·mol-1,可知石墨比金刚石更稳定 |
| C.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2 H2O(l)△H=-285.8 kJ·mol-1 |
| D.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ·mol-1,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ |
常温下,将C1 mol·L-1的盐酸和C2 mol·L-1的氨水等体积混合,下列叙述错误的是
| A.c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| B.当C1= C2时,c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.当pH=7,一定是C2>C1 |
| D.当pH<7,一定是C1=C2 |
下列叙述正确的是
| A.往待测液中滴加氯水,然后滴加KSCN溶液,以检测待测液中是否含有Fe2+ |
| B.往待测液中滴加BaCl2,然后滴加盐酸,以检测待测液中是否含有SO42- |
| C.蒸馏操作时应将温度计的水银球插入液面下 |
| D.向试管中加入5mL SO2水溶液,然后滴加BaCl2溶液,再滴加3%的H2O2溶液,以检测SO2具有还原性 |
下列离子方程式书写正确的是
| A.向水中通入氯气:Cl2+H2O=2H++Cl-+ClO- |
| B.向氯化铁溶液中加入铜:2Fe3++3Cu=2Fe+3Cu2+ |
| C.将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D.镁和稀硝酸反应:Mg+2H+= Mg2++H2↑ |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;Z2-离子半径大于W-离子半径;Y是一种重要的半导体材料。下列说法中错误的是
| A.元素X、M可形成既含离子键又含共价键的化合物 |
| B.气态氢化物的稳定性:Z<W |
| C.Y元素在自然界中以化合物的形式存在 |
| D.W元素的含氧酸都属于强酸 |
分子式为C10H14的烃,有一个苯环、两个取代基,其可能的结构有
| A.3种 | B.6种 | C.7种 | D.9种 |
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应产物中SO2和NH3的物质的量之比为
| A.1:4 | B. 3:4 | C. 4:1 | D.4:3 |
Ⅰ.铁是一种过渡元素,金属铁是最常用的金属之一。请回答下列问题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为 ,上述反应生成的磁性固体与过量浓硝酸反应后的溶液中含有的盐的化学式为 。
(2)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾。利用烧渣制绿矾的过程如下:
①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出) 。
②向溶液X中加入足量铁屑的目的是 。
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时向FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全)
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了)。
Ⅱ.(1)某溶液中有Mg2+、Fe3+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的金属阳离子是________;用离子方程式解释其原因_________________。
(2)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式______________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11 Ksp[Al(OH)3]="3×10" -34)。
(3)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 浓度 浓度 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,Q 0
(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.混合气体的平均相对分子质量不再改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(2)若以下图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极发生 (填“氧化”或“还原”)反应,电极反应式为 。
(14分)I.草酸晶体的组成可用H2C2O4·x H2O表示,为了测定x值,进行如下实验:
(1) 称取Wg草酸晶体,配成100.00mL水溶液
(2) 取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L—1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 = K2SO4 + 10CO2↑ + 2MnSO4 + 8H2O
试回答:
①在滴定过程中若用去amol·L—1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol·L—1,由此可计算x的值是 。
②若滴定终点读数时俯视,则计算的x值可能会 (偏大、偏小、无影响)。
Ⅱ.实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
提示:乙醇与浓硫酸在140℃时脱水生成乙醚,在170℃时脱水生成乙烯。
有关数据列表如下:
| |
乙醇 |
1,2-二溴乙烷 |
乙醚 |
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g · cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
回答下列问题:
(1)装置D中发生主要反应的化学方程式为 。
(2)装置B的作用 ,长玻璃管E的作用 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4) 反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 ;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”)。
(5)若产物中有少量未反应的Br2,最好用 洗涤除去 (填正确选项前的字母) 。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
【化学选修2:化学与技术】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下: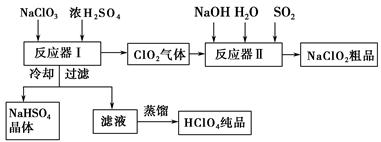
已知:①NaHSO4溶解度随温度的升高而增大,适当 条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 ,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
【化学选修3:物质结构与性质】
(1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图。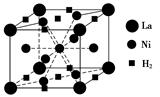
①Ni在元素周期表中的位置是 ,其基态原子的外围电子排布式 是 。
②该合金储氢后,含1 mol La的合金可吸收H2的物质的量为 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为 。
②BH—4的空间构型是 (用文字描述)。
(3)液氨是富氢物质,是氢能的理想载体,利用N2+3H2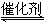 2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+离子中,N原子是配位原子
d.CN—的电子式为: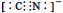
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图12所示,已知该晶体的密度ag·cm-3,则晶胞的体积为 cm3〔用含a、NA的代数式表示(NA表示阿伏伽德罗常数)〕。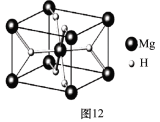
【化学选修5:有机化学基础】
已知:
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5molA完全燃烧只生成3mol CO2和2.5molH2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成六元环状酯类化合物。
请回答:
(1) A的分子式是 。
(2)1mol B与足量的金属钠反应产生22.4L(标准状况)H2。B中所含官能团的名称是 。B与C的相对分子质量之差为4,B→C的化学方程式是 。
(3) D的同分异构体G所含官能团与D相同,则G的结构简式可能是 、 。
(4)F可发生多种类型的反应。
①两分子F反应生成的六元环状酯类化合物的结构简式是 ;
②由F可生成使Br2的CCl4溶液褪色的有机物H。F→H的化学方程式是 。
③F在一定条件下发生缩聚反应的化学方程式是 。
(5)A的结构简式是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号