福建省福州八县高二下学期期末考试化学试卷
下列说法不正确的是( )
| A.离子晶体的晶格能越大,离子键越强 |
| B.阳离子的半径越大则可同时吸引的阴离子越多 |
| C.通常阴、阳离子的半径越小、电荷越大,该阴阳离子组成的离子化合物的晶格能越大 |
| D.拆开1mol离子键所需的能量叫该离子晶体的晶格能 |
下列说法中正确的是( )
| A.共价键的键能越大,分子晶体的熔点越高 |
| B.失去电子难的原子获得电子的能力一定强 |
| C.在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 |
| D.电子层结构相同的不同简单离子,其半径随核电荷数增多而减小 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是( )
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质化合生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是( )
| A.三氯化硼液态时能导电而固态时不导电 | B.硼原子以sp杂化 |
| C.三氯化硼遇水蒸气会产生白雾 | D.三氯化硼分子属极性分子 |
磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )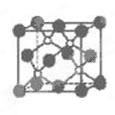
| A.磷化硼晶体的化学式为BP,属于离子晶体 |
| B.磷化硼晶体的熔点高,且熔融状态下能导电 |
| C.磷化硼晶体中每个原子均形成4个共价键 |
| D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 |
几种短周期元素的原子半径及主要化合价如下表,相关说法正确的是
| 元素代号 |
L |
M |
X |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
A.离子半径大小:r(M3+) >r(T2-) B.其中R的金属性最强
C.煤和石油中存在X元素 D.L、X形成的简单离子核外电子数相等
A、B、C三种短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则下列说法正确的组合是
| A |
B |
| C |
|
①B、C形成的单质均存在同素异形体 ②X的种类比Y多
③常温下,B的氢化物不能电离出H+ ④C的最高价氧化物对应的水化物是强酸( )
A.①②③④ B.②④ C.①② D.①③
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为: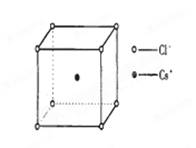
A.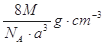 |
B. 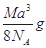 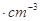 |
C.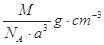 |
D.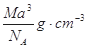 |
下列化合物分子中一定既含σ键又含π键的是( )
| A.N2 | B.CO2 | C.C2H6O | D.H2O2 |
下列各项所述的数字不是6的是 ( )
| A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl- 的个数 |
| B.在金刚石晶体中,最小的环上的碳原子个数 |
| C.在二氧化硅晶体中,最小的环上的原子个数 |
| D.在NaCl晶体中,与一个Cl-最近的且距离相等的Na+ 的个数 |
有关乙烯分子中的化学键描述正确的是( )
| A.每个碳原子的sp2杂化轨道中的其中一个形成π键 |
| B.每个碳原子的未参加杂化的2p轨道形成σ键 |
| C.碳原子的三个sp2杂化轨道与其它原子形成三个σ键 |
| D.碳原子的未参加杂化的2p轨道与其它原子形成σ键 |
下列数据是对应物质的熔点,有关的判断错误的是( )
| Na2O |
Na |
AlF3 |
AlCl3 |
Al2O3 |
BCl3 |
CO2 |
SiO2 |
| 920℃ |
97.8℃ |
1291℃ |
190℃ |
2073℃ |
-107℃ |
-57℃ |
1723℃ |
A.含有金属阳离子的晶体不一定是离子晶体
B.在共价化合物分子中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,有良好的绝缘性、阻燃,在电器工业方面具有广泛用途。下列推测正确的是( )
| A.SF6中各原子均达到8电子稳定结构 | B.SF6二氯取代物有3种 |
| C.SF6分子是含有极性键的非极性分子 | D.SF6是原子晶体 |
下列变化或数据与氢键无关的是( )
| A.甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1 |
| B.氨分子与水分子形成一水合氨 |
| C.水结冰体积增大。 |
| D.SbH3的沸点比PH3高 |
下列物质的熔点高低顺序,正确的是( )
| A.金刚石>晶体硅>碳化硅 | B.K>Na>Li |
| C.NaF<NaCl<NaBr | D.CI4>CBr4>CCl4>CH4 |
下列各组分子中,都属于含有极性键的非极性分子的一组是( )
| A.CO2、H2O | B.C2H4、CH4 | C.Cl2、C2H2 | D.NH3、HCl |
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )。
| A.X、Y、Z、W的原子半径依次减小 |
| B.W与X形成的化合物中只含离子键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成形成YM3分子;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是( )
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由Y、Z、M三种元素形成的化合物一定既有离子键,又有共价键 |
短周期元素X、Y、W、Q在元素周期表中的相对位置如下图所示。Y是地壳中含量最多的元素。下列说法正确的是( )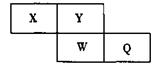
| A.1mol Q单质与氢氧化钠溶液反应转移的电子数目为2 NA |
| B.X的气态氢化物能使湿润的蓝色石蕊试纸变红 |
| C.氢化物的沸点:H2Y>HQ |
| D.最髙价氧化物的水化物的酸性:W > Q |
向盛有硝酸银水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到无色的透明溶液,下列对此现象的说法正确的是( )
| A.反应前后Ag+的浓度不变 |
| B.沉淀溶解后,生成[Ag (NH3) 2] OH难电离 |
| C.配合离子[Ag (NH3)2] +存在离子键和共价键 |
| D.配合离子[Ag (NH3)2] +中,Ag+提供空轨道,NH3给出孤对电子 |
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
|
|
|||||||||||||||
| b |
|
|
|
c |
d |
e |
f |
|
|||||||||
| g |
h |
i |
j |
|
k |
l |
m |
||||||||||
| n |
|
|
|
|
|
o |
p |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式: 。
(2)c与a形成6个原子组成分子结构简式: ,
该分子是: (填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
| 元 素 |
O |
P |
|
| 电离能 kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是 ;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 。
(1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式 。
(2)A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子。D离子的半径在B、C、D中为最小。则:
①A是_________,B是_________,C是_________,D是_______。(填名称)
②A单质和B单质充分反应生成的化合物的结构式是____________。
③B的一种同位素形成的单质,1mol这种单质中含中子的物质的量是20mol,则这种同位素原子质量数________。
(3)NH3·H2O的电离方程式为NH3·H2O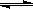 NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母) 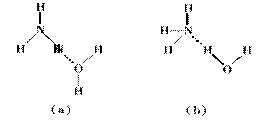
(4)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl,CoCl3·5NH3中Co化合价为 ,请写出表示此配合物结构的化学式: 。
(5)H2O、H2S、H2Se熔沸点由低到高的顺序: 。
(6)HF比HCl热稳定 (填“强”或“弱”),原因是: ____________。
铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。
②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。
[Cu(NH3)n]+中Cu+与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):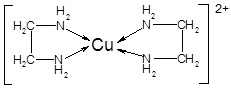
请回答下列问题:
①配离子[Cu(En)2]2+的中心原子基态第L层电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是: 。
③配合物[Cu(En)2]Cl2中不存在的作用力类型有 (填字母);
A 配位键 B 极性键 C 离子键 D 非极性键 E.氢键 F.金属键
1-36号A、B、C、D、E 、F六种元素,其中A、B、C、D、E的原子序数均小于18且其核电荷数依次递增,B元素基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,D原子的价电子排布为ns2np2n+2, E原子第一至第四电离能(kJ·mol-1)分别为:738、1451、7733、10540。F2+离子K、L、M层全充满。根据以上信息,同答下列问题:
(1)BA4D和BA2D,沸点较高的是 (填相关物质的结构简式)
(2)已知B与A形成的化合物在标准状况下的密度为1.16g·L-1,则在该化合物分子空间构型 ,在该化合物分子中含有σ键和π键个数比 。
(3)写出单质F与足量C的最高价氧化物对应的水化物稀溶液反应,C被还原到最低价,该反应的化学方程式 。
(4)下图能正确表示第三周期部分元素的第二电离能(I2)与原子序数关系 (填标号)。
(5)B的单质是一种层状结构,元素B和E的形成一种合金,E的原子位于B的层间,其投影位于层面六圆环的中央,“△”表示E的原子位置,平行四边形表示在此二维图形上画出的一个晶胞,该合金的化学式为________。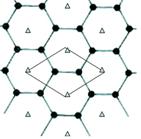
 粤公网安备 44130202000953号
粤公网安备 44130202000953号