江苏省太仓市九年级5月学科教学质量调研化学试卷
PM2.5是指大气中直径小于或等于2.5微米的颗粒物,它们直径小,富含大量有害物质,且在大气中停留时间长,对人体健康影响很大。下列情况不会增加空气中PM2.5的是
| A.露天焚烧秸秆 | B.利用太阳能发电 | C.汽车排放尾气 | D.直接用煤作燃料 |
下列化学用语书写正确的是
| A.1个氖原子:Na | B.+2价的铁元素: |
| C.4个氢分子:4H | D.3个硝酸根离子:3NO |
下列是生活中常见的一些现象,其中属于化学变化的是
| A.石蜡熔化 | B.瓷碗破碎 |
| C.洗净的铁锅出现锈渍 | D.潮湿的衣服被晒干了 |
下列物质(或主要成分)的名称、俗名与化学式一致的是
| A.碳酸氢钠、小苏打、Na2CO3 | B.氢氧化钠、纯碱、NaOH |
| C.氧化钙、熟石灰、CaO | D.氯化钠、食盐、NaCl |
下列化肥中,属于复合肥料的是
| A.KNO3 | B.NH4NO3 | C.K2SO4 | D.Ca(H2PO4)2 |
下列有关操作及实验现象的描述正确的是
| A.打开浓盐酸的试剂瓶塞,一会儿瓶口会产生白烟 |
| B.振荡试管时,用手紧握试管,拇指堵住试管口,上下晃动 |
| C.含碘酸钾(KIO3)的食盐水滴在馒头片上,出现蓝色 |
| D.向蛋清溶液中滴几滴浓硝酸,微热,出现黄色固体 |
下列有关二氧化碳的说法错误的是
| A.二氧化碳通入紫色石蕊试液变红 |
| B.二氧化碳可用于灭火 |
| C.用块状石灰石和稀硫酸迅速制备大量二氧化碳 |
| D.空气中二氧化碳含量增多会引起“温室效应” |
物质的性质决定其用途,下列因果关系不成立的是
| A.稀硫酸能与金属反应,用于去除铁锈 |
| B.洗洁精具有乳化功能,用于去除油污 |
| C.钨的熔点高且能导电,用于制作白炽灯丝 |
| D.镁粉燃烧发出耀眼白光,用于制作照明弹 |
下列有关水的说法中不正确的是
| A.水是一种最常用的溶剂 |
| B.自然界中的水经过沉淀、过滤、吸附后可得到纯水 |
| C.鉴别软水和硬水可以用肥皂水 |
| D.农药、化肥的不合理施用,会造成水体污染 |
下列有关氧气的说法正确的是
| A.夏天食物腐烂与氧气无关 |
| B.鱼、虾等能在水中生存,是由于氧气极易溶于水 |
| C.可燃物接触氧气就能够燃烧 |
| D.铁丝在氧气中燃烧,火星四射,生成黑色固体 |
在一定条件下,下列物质间的转化不能一步实现的是
| A.Cu→Cu(NO3)2 | B.CO2→H2CO3 | C.H2O2→H2 | D.NaOH→Na2SO4 |
下列关于铁的说法正确的是
| A.铁是地壳中含量最多的金属元素 |
| B.生铁可以完全溶解在足量的稀盐酸中 |
| C.废弃铁制品回收成本太高,属于不可回收垃圾 |
| D.不能用铁桶盛放波尔多液 |
a、b、c三种物质的溶解度曲线如右图所示。取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃。下列说法不正确的是
| A.原饱和溶液中,溶质的质量分数:a>b=c |
| B.恢复至t2℃时,析出溶质的质量:a>b=c |
| C.恢复至t2℃时,三种溶液一定都是饱和溶液 |
| D.若继续降温至t1℃,三种溶液一定都是饱和溶液 |
据报道,药物扎那米韦(化学式为C12H20N4O7)对人感染H7N9禽流感病毒治疗有效。下列有关扎那米韦的说法不正确的是
| A.扎那米韦中碳元素、氢元素和氮元素的质量比为3:5:1 |
| B.1个扎那米韦分子由12个碳原子、20个氢原子、4个氮原子和7个氧原子构成 |
| C.扎那米韦的相对分子质量为332 |
| D.扎那米韦不属于有机高分子化合物 |
利用下列仪器制取相关气体,不能实现的是
| A.用高锰酸钾加热分解制取氧气 | B.用双氧水和二氧化锰制取氧气 |
| C.用锌和稀硫酸制取氢气 | D.用石灰石和稀盐酸制取二氧化碳 |
下列有关原子结构的说法中正确的是
| A.氢、碳、氧的原子核都由质子和中子构成 |
| B.“毒大米”中含有金属铬(Cr),铬原子序数为24,则质子数和中子数都为24 |
C.氯原子的结构示意图为 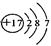 ,在反应中若得到一个电子即变成氯离子(Cl-) ,在反应中若得到一个电子即变成氯离子(Cl-) |
| D.质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷 |
下列有关硫酸的说法错误的是
| A.硫酸浓度越大,密度越大,pH越大 |
| B.浓硫酸倒入水中,溶液温度升高 |
| C.实验室中常用浓硫酸作某些气体的干燥剂,这是利用了浓硫酸的吸水性 |
| D.锌和稀硫酸反应后的溶液为无色 |
用下列图示操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液。下列说法中正确的是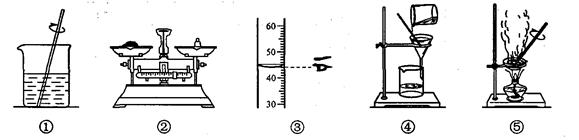
| A.甲实验的操作顺序是①④⑤,其中去除杂质的关键步骤是蒸发 |
| B.甲实验各步操作中,玻璃棒的作用都是相同的 |
| C.乙实验若按照操作顺序②③①进行,则配制的溶液浓度偏大(水的密度为1 g·cm-3) |
| D.乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 |
下列有关熟石灰的说法不正确的是
| A.在石灰窑中用石灰石经高温煅烧可制得熟石灰 |
| B.农业上常用熟石灰来改良酸性土壤 |
| C.熟石灰的溶解度随温度升高而减小 |
| D.实验室可用熟石灰和纯碱(Na2CO3)等物质作原料来制备少量氢氧化钠 |
生活处处有化学,下列做法正确的是
| A.碘是人体需要的微量元素,需大量补充 |
| B.霉变大米、花生等含有黄曲霉素,蒸煮后可食用 |
| C.腌制的泡菜虽然含亚硝酸盐,但多吃无妨 |
| D.有的指甲油中含有少量的甲醛,青少年应尽量少用 |
通过观察下列实验现象,不能达到实验目的的是
| A.图1观察木条能否复燃,检验是否为氧气 |
| B.图2观察反应有无气泡产生,判断是否为碳酸钠 |
| C.图3观察反应剧烈程度,比较镁与锌的活动性 |
| D.图4观察燃烧先后顺序,比较可燃物的着火点 |
下列各组离子能在pH=14的水溶液中大量共存的是
A.Na+、K+、Cl-、NO |
B.Fe3+、Ca2+、CO 、SO 、SO |
C.Ba2+、H+、Cl-、NO |
D.Na+、NH 、NO 、NO 、Cl- 、Cl- |
以下操作可以达到实验目的是
| A.加水溶解并过滤除去CaO中的CaCO3 |
| B.用适量盐酸除去KCl溶液中混有的少量K2CO3 |
| C.用灼烧的方法除去铜粉中混有的少量木炭粉 |
| D.通入适量的氧气后点燃除去二氧化碳中少量一氧化碳气体 |
某溶液中含n个K+,n个SO ,n个Cl-,除存在不等数目的H+和OH-外,别无其它离子存在,请你推测此溶液
,n个Cl-,除存在不等数目的H+和OH-外,别无其它离子存在,请你推测此溶液
| A.pH>7 | B.pH=7 | C.pH<7 | D.pH≥7 |
下列有关物质的检验方法和结论都正确的是
| A.经点燃,产生蓝色火焰的气体一定是一氧化碳 |
| B.向某无色溶液中滴入酚酞试液,溶液变红色,该溶液一定是碱溶液 |
| C.向某无色溶液中滴入盐酸,无明显现象,再滴入氯化钡溶液,产生白色沉淀,该溶液中一定含有硫酸根离子 |
| D.把燃着的木条伸入某无色气体中,木条熄灭,该气体一定是二氧化碳 |
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如右图所示,下列说法正确的是
| A.a点溶液中的溶质有2种 |
| B.c点溶液中溶质为Zn(NO3)2 |
| C.若取b~c段溶液,滴加稀盐酸,有白色沉淀 |
| D.取d点的固体,加入稀盐酸,无气泡产生 |
实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,设计了实验,实验过程如下:
实验一:取少量样品于试管中,滴加适量稀盐酸,观察到有气泡产生,说明氢氧化钠已变质,变质的原因是_____________________(用化学方程式表示)。
实验二:
通过实验二,能进一步推算出氢氧化钠变质的程度。请列式计算实验二中16.0样品中各成分的质量。
结论:16.0 g样品中已变质的氢氧化钠的质量是_______g。
在学习了金属的化学性质后,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
(1)写出稀硫酸与锌反应的化学方程式______________。
(2)小兵用下图装置收集并测量氢气的体积,其中量筒的作用是__________________,氢气应从_______(填e或f或g)管通入。
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的
实验编号是_______,
【得出结论】
(4)结论是________________________________________________________。
【评价与反思】
(5)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。
______________________________________________________________________。
中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
(1)上图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。
请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶
液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的_______(填甲或乙)图所示进行的。
②曲线上M点表示盐酸和氢氧化钠溶液反应的情况是_______。
③向烧杯中倾倒20 g(滴有2滴酚酞试液)质量分数为4.0%的氢氧化钠溶液,振荡,再逐滴滴入质量分数为7.3%的稀盐酸,边滴边振荡,直至溶液刚好变为_______色为止,共用去稀盐酸10 g,则反应后溶液中溶质质量分数为_______。要使反应后的溶液变成20℃时的饱和溶液,需要加入氯化钠固体的质量是_______g(结果精确到0.1 g)。已知:20℃时氯化钠的溶解度为36.0 g。
(2)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:
根据图示实验,甲同学认为:NaOH与稀盐 酸发生的中和反应是放热反应。乙同学认为:甲同学得出这个结论的依据不科学,理由是__________。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5 g溶质质量分数分别为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40 g 20%的氢氧化钠溶液,最后测量其温度,数据记录如下:
实验结论:影响该中和反应放出热量多少的因素是_______。
某化工厂排出的废水透明、澄清、略显蓝色。某同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成。过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,产生蓝色沉淀。试回答:
(1)废水中一定含有的物质_______(填编号)。
A.氯化物 B.硫酸盐 C.硝酸盐 D.碳酸盐
(2)该同学查阅有关资料后,设计了一个从废水中除去重金属离子的实验方案:
①固体A中一定含有的物质为(写化学式)_______。
②B溶液中的溶质一定含有_______(填序号字母)。
A.Na2CO3 B.Fe(NO3)2 C.MgCl2 D.Ba(NO3)2
③Ⅲ通空气时的化学方程式是4Fe(OH)2+2H2O+O2=4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O,在第Ⅲ步中应控制“一定量空气”的目的是_______。
④第Ⅳ步反应的化学方程式为_______。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号