江苏省泰州市高港区中考一模化学试卷
下列生产或加工产品的过程中主要发生物理变化的是
| A.烧制陶器 | B.海水晒盐 | C.冶炼生铁 | D.粮食酿酒 |
人误服重金属盐中毒后,为了减轻毒性,可服用下列物质中的
| A.水 | B.食盐水 | C.鸡蛋清 | D.肥皂水 |
“花气袭人知骤暖,鹊声穿树喜新晴”描述了春天晴暖、鸟语花香的山村美景。下列从微观角度对“花气袭人知骤暖”的解释最合理的是
| A.温度越高,微粒运动越快 | B.微粒间有空隙 |
| C.微粒的体积小、质量轻 | D.微粒在不断运动 |
为了区别O2与CO2两瓶(或两种)无色气体,下列方法中不可行的是
| A.分别通入紫色石蕊溶液中 |
| B.用燃着的木条分别伸入瓶中 |
| C.分别倒入少量NaOH溶液,振荡 |
| D.用塑料可乐瓶分别盛满上述两种气体,各倒入1∕5容积的水,盖紧瓶盖,振荡 |
五氧化二磷由磷、氧两种元素组成,这两种元素的本质区别是
| A.质子数不同 | B.电子数不同 | C.中子数不同 | D.最外层电子数不同 |
蜡烛(足量)在如下左图密闭的集气瓶内燃烧至熄灭,用仪器测出瓶内氧气含量的变化如下右图所示。下列判断正确的是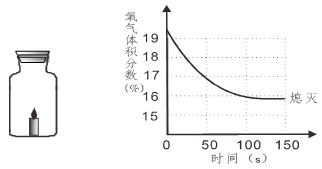
| A.蜡烛燃烧前瓶内只有氧气 |
| B.氧气浓度小于一定值时,蜡烛无法燃烧 |
| C.过程中瓶内物质总质量不断减少 |
| D.蜡烛熄灭后瓶内只剩二氧化碳气体 |
下列对生活中各种材料的有关认识正确的是
| A.聚乙烯和聚氯乙烯均可用于食品包装 |
| B.普通玻璃和有机玻璃均属于无机非金属材料 |
| C.羊毛和化纤制品被灼烧时会产生相同的气味 |
| D.铝合金、不锈钢、储氢合金都属于金属材料 |
6月5日是世界环境日。下列说法或做法不符合“低碳减排,绿色生活”理念的是
| A.日常生活提倡用布袋代替塑料袋 | B.公交出行,少用私车 |
| C.为便于使用,电脑一直处于待机状态 | D.随手关灯,节约用电 |
同学们对某无色溶液所含溶质的记录,合理的是
| A.HCl、NaOH、NaCl | B.KNO3、NaCl、AgNO3 |
| C.CuSO4、H2SO4、NaCl | D.NaOH、Na2CO3、NaCl |
某同学的化学笔记本上记录了很多化学知识。以下是其中的四个知识点,错误的是
| A.分子、原子、离子都能直接构成物质 |
| B.淀粉和纤维素都属于糖类,所蕴含的能量来自于太阳能 |
| C.铝的抗氧化能力强是因为铝的表面容易形成一层致密的氧化物薄膜 |
| D.农业上,可以用碱性物质改良酸性土壤,如氢氧化钠等 |
如图是A、B两种物质的溶解度曲线,下列叙述错误的是
A.30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液
B.20℃时A、B两物质的饱和溶液溶质质量分数相等
C.A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液
D.30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法
用括号内物质不能一次性区别开下列各组物质的是
| A.NH4NO3、CaCO3、KCl 三种固体(水) |
| B.CaCl2、Na2CO3、K2SO4三种溶液 〔Ba(OH)2溶液〕 |
| C.Cu、Fe、CuO三种固体(稀盐酸) |
| D.MgCl2、NaNO3、K2CO3三种溶液 〔Ca(OH)2溶液〕 |
除去下列各组物质中的杂质,所用试剂和方法均正确的是
| |
物质 |
杂质 |
除杂所用试剂和方法 |
| A |
O2 |
HCl气体 |
先通过NaOH溶液,再通过浓硫酸 |
| B |
NaOH |
Ca(OH)2溶液 |
先加入过量的Na2CO3溶液,再过滤 |
| C |
NaCl |
Na2CO3 |
先加入过量的澄清石灰水,再过滤 |
| D |
CaO |
CaCO3 |
加入适量的稀盐酸,蒸发 |
金属加工后的废切削液中含有2~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl="=" NH4NO2+X 第二步:NH4NO2===N2↑+2H2O
下列说法错误的是
| A.NaNO2的名称是硝酸钠 | B.金属加工后的废切削液中含氮元素,可用作氮肥 |
| C.第一步反应中X的化学式为NaCl | D.第二步反应属于分解反应 |
(1)请用化学符号表示:
①空气中含量最多的物质 ;②人体缺 元素有可能导致骨骼疏松、畸形,易得佝偻病;③稀硫酸能导电是因为稀硫酸中含有较多自由移动的 、 离子。
(2)化学就在我们身边,它与我们的生活息息相关。请回答下列问题:
①铁制品在空气中易生锈,铁锈的主要成分是 (写化学式)。
②炒菜时油锅中的油不慎着火,可以采取的灭火方法是 。
③天然气是家用燃料之一,请写出天然气燃烧的化学方程式 。
④石灰水暴露于空气中易变质,写出变质反应的化学方程式 。
(8分)根据所学知识并结合所示装置回答下列问题。
(1)写出a、b仪器的名称:a ,b 。
(2)实验室加热高锰酸钾制取氧气,发生装置A应作何改进 ,反应的化学方程式为 。
(3)用装置B制取一种气体的化学方程式为 。
(4)实验室常用氯化铵固体与熟石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性。
①制取并收集NH3,应该从上图中选择的发生装置是 ,收集装置是 。
②NH3是一种碱性气体,干燥时不能选用下列干燥剂中的 (填“A”或“B”)。
A.固体氢氧化钠 B.浓硫酸
用金属铁制备自来水的新型消毒、净水剂K2FeO4的流程如下:
请回答下列问题:
(1)产品K2FeO4中Fe的化合价是 ;
(2)固体B的成分是 ,溶液C一定含有的溶质是 ;
(3)操作I的名称是 ,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需 ,请说出该仪器的另外一种用途 。
(4)请写出有关反应的化学方程式,并回答问题:
反应① ,属于 (填基本反应类型);
反应③中沉淀D与H2O2发生化合反应,反应的化学方程式为 。
氢氧化钠与盐酸的反应无明显现象,某化学兴趣小组为证明氢氧化钠与盐酸发生了化学反应,进行了如下的实验探究。
【实验探究一】小云在试管中加入约2mL稀氢氧化钠溶液,滴入2滴酚酞溶液,振荡,溶液变为红色。然后向该试管中滴加稀盐酸,观察到溶液 ,证明氢氧化钠与盐酸发生了反应,该反应的化学方程式为 。
【反思评价】 小霞提出也可以使用石蕊试液代替无色酚酞进行上述实验。你认为 (填“无色酚酞”或“石蕊试液”)更适合用于验证二者恰好完全反应,你的理由是 。
【实验探究二】小兰同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
| 编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
| 1 |
3.65﹪ |
2.00﹪ |
3.5 |
| 2 |
3.65﹪ |
4.00﹪ |
x |
| 3 |
7.30﹪ |
8.00﹪ |
14 |
表中x = 。
【反思评价】某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。但有同学认为单凭此现象不足以说明该反应放热,其理由是 。
【拓展延伸】不是所有的碱与盐酸反应都无明显现象,例如 (填一种碱)与盐酸反应就有明显的实验现象。
为综合利用生产过程中的副产品CaSO4,某化工厂设计了以下制备(NH4)2SO4的工艺流程:
(1)此流程中,在沉淀池发生的化学反应为CO2+2NH3+CaSO4+H2O==CaCO3↓+ (NH4)2SO4
在煅烧炉中发生的化学反应方程式为 ;该工艺中可循环使用的X为 (填化学式);副产品Y有何用途 (填一种即可)。
(2)从贮液池中获得(NH4)2SO4晶体要进行操作b,操作b是 。若经过一定处理后的贮液池中,形成30℃时(NH4)2SO4的饱和溶液,则此时溶质质量分数为 (已知30℃时硫酸铵的溶解度为78g)。
(3)欲制备6.6t (NH4)2SO4晶体,理论上需要CaSO4多少吨?

 粤公网安备 44130202000953号
粤公网安备 44130202000953号