高考化学 题型十 粒子变化型专题练习卷
在0.1 mol·L-1的NH4HSO4溶液中,下列微粒的物质的量浓度关系不正确的是 ( )
| A.c(H+)>c(SO42-)>c(NH4+) |
| B.c(NH4+)+c(H+)=2c(SO42-)+c(OH-) |
| C.c(H+)=c(NH4+)+c(NH3·H2O)+c(OH-) |
| D.室温下滴加NaOH溶液至中性后:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
在常温下,0.100 0 mol·L-1 Na2CO3溶液25 mL用0.100 0 mol·L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
| A.a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D.d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
将适量AgBr固体溶在水中,溶液中存在AgBr(s)  Ag+(aq)+Br-(aq)。则下列说法正确的是( )
Ag+(aq)+Br-(aq)。则下列说法正确的是( )
| A.向此体系中滴加足量浓NaCl溶液,发现沉淀转化为白色,说明Ksp(AgCl)<Ksp(AgBr) |
| B.向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)增大 |
| C.此体系中一定存在c(Ag+)=c(Br-)=[Ksp(AgBr)]1/2 |
| D.某溶液中c(Ag+)·c(Br-)=Ksp(AgBr),说明此时c(Ag+)=c(Br-) |
下列溶液中微粒浓度关系一定正确的是( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加等浓度等体积的NaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
下列说法正确的是( )
A.常温下0.4 mol·L-1 HB溶液和0.2 mol·L-1 NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为c(Na+)>c(B-)>c(H+)>c(OH-)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
C.常温下0.1 mol·L-1的下列溶液①NH4Al(SO4)2,②NH4Cl,③NH3·H2O,④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1 mol·L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是( )
| A.原H2S溶液的物质的量浓度为0.05 mol·L-1 |
| B.氢硫酸的酸性比亚硫酸的酸性强 |
| C.b点水的电离程度比c点水的电离程度大 |
| D.a点对应溶液的导电性比d点强 |
常温下,有下列四种溶液:
| ① |
② |
③ |
④ |
| 0.1 mol·L-1NaOH溶液 |
pH=11 NaOH溶液 |
0.1mol·L-1 CH3COOH溶液 |
pH=3 CH3COOH溶液 |
下列说法正确的是( )
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
在25 ℃时,将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是( )
| A.该溶液的pH小于7 |
| B.c(CH3COOH)+c(CH3COO-)=0.20 mol·L-1 |
| C.c(CH3COOH)<c(CH3COO-) |
| D.c(CH3COO-)+c(OH-)=0.10 mol·L-1 |
常温下,对于1 L 0.005 mol·L-1硫酸表述中正确的是( )
| A.由水电离出的c(H+)=1.0×10-12 mol·L-1 |
| B.加水稀释后,溶液中所有离子的浓度均减少 |
| C.2c(H+)=c(SO42-)+c(OH-) |
| D.滴加稀氨水使pH=7,则c(NH4+)=c(SO42-) |
一定温度下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液,溶液pH变化的曲线如图所示。下列叙述中正确的是( )
| A.①点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) |
| B.②点的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) |
| C.③点的溶液中:c(Na+)=2c(ClO-)+c(HClO) |
| D.④点的溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
常温下,向100 mL 0.1 mol·L-1 H2A(二元酸)溶液中逐滴加入0.2 mol·L-1 NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列有关说法正确的是( )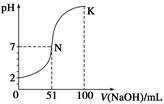
| A.H2A为二元强酸 |
| B.N点对应溶液有:c(Na+)=c(A2-)+c(HA-) |
| C.K点对应溶液中离子浓度由大到小的顺序为c(A2-)>c(Na+)>c(OH-)>c(H+) |
| D.K点时加水稀释溶液,c(H+)增大 |

 粤公网安备 44130202000953号
粤公网安备 44130202000953号