福建省四地六校高二下学期第一次月考化学试卷
金属的下列性质中与金属晶体结构无关的是( )
| A.导电性 | B.化学反应中易失去电子 |
| C.延展性 | D.硬度 |
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核核磁共振,下列原子组一定能产生NMR现象的是( )
A.18O、31 P、119 Sn B.27 Al、19 F、12 C
C.6C、16S、9F D.1 H、13 C、35 Cl
具有下列最外层电子排布的基态原子,其相应的元素一定属于主族的是( )
| A.ns1 | B.ns2 | C.ns2np6 | D.ns2np2 |
下列基态原子的电子排布式中,其未成对电子数最多的是( )
| A.1s22s22p63s23p63d54s1 |
| B.1s22s22p63s23p3 |
| C.1s22s22p63s23p63d64s2 |
| D.1s22s22p63s23p63d74s2 |
已知某元素+3价离子的电子排布为:1s22s22p63s23p63d5,该元素在周期表中的位置正确的是( )
| A.第三周期第Ⅷ族, | B.第四周期第ⅤA族, |
| C.第三周期第ⅤB族, | D.第四周期第Ⅷ族 |
下列各组元素性质的递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.C、P、S元素最高正价依次升高
C.N、O、F电负性依次增大
D.Na、K、Rb第一电离能逐渐增大
根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
| A.离子半径:S2->Cl->Ca2+ | B.原子半径:Ca>S>Cl |
| C.酸性:HClO4<HBrO4<HIO4 | D.热稳定性:HCl>H2S>H2Se |
X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外电子排布相同,下
列说法中正确的是( )
| A.X的原子半径比Y小 | B.第一电离能X<Y |
| C.电负性X>Y | D.X和Y的核电荷数之差为m-n |
短周期元素中,原子基态时具有1个未成对电子的元素共有多少种( )
| A.5 | B.6 | C.7 | D.8 |
下列说法中不正确的是( )
| A.减压分馏、常压分馏都是物理变化 |
| B.乙酸乙酯和食用植物油均可水解生成乙醇 |
| C.蔗糖、麦芽糖互为同分异构体 |
| D.甘油、汽油都不属于油脂 |
下列说法正确的是( )
| A.蛋白质、淀粉、纤维素和油脂都是高分子有机物 |
| B.苯和乙酸乙酯都能发生取代反应 |
| C.煤干馏可得苯及甲苯等,是由于煤中含有苯及甲苯等物质 |
| D.淀粉、纤维素和蛋白质水解都生成葡萄糖 |
下列说法正确的是( )
| A.乙烷、乙烯、乙醇、乙醛和乙酸都可使酸性高锰酸钾溶液褪色 |
| B.乙烯和苯使溴水溶液褪色原理相同 |
| C.聚乙烯和氯乙烯都是通过加聚反应产生的 |
| D.乙酸、乙酸乙酯和豆油都能与氢氧化钠溶液反应 |
下列叙述正确的是( )
| A.金属元素的原子只有还原性,离子只有氧化性 |
| B.用乙烷(CH3CH3)或乙烯(CH2=CH2)制一氯乙烷(CH3CH2Cl)的反应类型相同 |
| C.煤油是通过煤干馏获得,可用作燃料和保存少量金属钠 |
D. 和CH3-CH=CH2互称为同分异构体 和CH3-CH=CH2互称为同分异构体 |
元素周期律和元素周期表是学习化学的重要工具,下列叙述不正确的是( )
| A.从左到右,元素周期表中的第13列为ⅢA族 |
| B.某ⅡA族元素的原子序数为x ,则与它同周期的ⅢA族元素的原子序数可能为x+25 |
| C.ⅥA族元素,随原子半径增大,对应气态氢化物的稳定性逐渐增强 |
| D.53号元素位于周期表P区、第五周期ⅦA族。 |
X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是( )
| 元素 |
X |
Y |
Z |
W |
| 原子半径(nm) |
0.077 |
0.075 |
0.102 |
0.099 |
| 最高正价或最低负价 |
+4 |
+5 |
-2 |
-1 |
A.X与W形成XW4时,各原子最外层均满 足8电子稳定结构,
B.1molW的单质参加氧化还原反应时转移的电子数为2mol
C.0.3molCu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体
D.Y的氢化物与W的氢化物反应的产物只含有共价键
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子的电子层结构都与氩相同,B的原子结构示意图为
(3)C元素是第三周期中无未成对电子的主族元素,它的轨道排布式为 ;
(4)D元素基态原子的M层全充满,N层只有一个未成对电子,D基态原子的电子排布式为
(5)E原子共有3个价电子,其中一个价电子位于第三能层d轨道,指出该元素在周期表中所处的周期数和族序数
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 1 |
① |
|
|
|||||
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
|
⑦ |
|
⑧ |
⑨ |
| 4 |
⑩ |
|
|
|
|
|
|
|
(1)写由上述元素组成的分子中电子总数为10的分子(至少两种): 。
(2)比较:②、③、④、⑤的第一电离能: > > > (写元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式是:
(4)具有两性的最高价氧化物是 (填化学式);写出其与氢氧化钠溶液反应的离子方程式: 。
(5)下表为原子序数依次增大的短周期元素A~E的第一到第五电离能数据。
| 电离能I(eV) |
A |
B |
C |
D |
E |
| I1 |
11.3 |
13.6 |
5.2 |
7.6 |
6.0 |
| I2 |
24.4 |
35.1 |
49.3 |
15.0 |
18.8 |
| I3 |
47.9 |
54.9 |
71.6 |
80.1 |
28.4 |
| I4 |
64.5 |
77.4 |
98.9 |
109.2 |
112.0 |
| I5 |
392.1 |
113.9 |
138.3 |
141.3 |
153.7 |
试回答:表中可能为非金属元素的是 (填字母);若D、E为同周期相邻元素,表中D比E的第一电离能略大,其原因是 。
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 |
A |
B |
C |
D |
| 性质结构信息 |
原子中最外层电子数为电子层数的2倍。常温下为淡黄色固体,其燃烧热为Q KJ/mol |
单质常温、常压下是气体,能溶于水。原子的M层p轨道有1个未成对的电子 |
单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 |
原子最外层电子层上s电子数等于p电子数。单质是一种重要的半导体材料。 |
(1)写出A的燃烧热方程式 。
(2)写出B单质与水反应的化学方程式 。
(3)电解B与C的化合物水溶液是重要化学工艺,写出离子方程式 。
(4)A与C形成的化合物存在的化学键为 (填“共价键”或“离子键”)。
(5)A、B、D三种元素电负性由小到大的顺序为 (写元素符号)。
(6)B、D两元素非金属性较弱的是 (写元素符号)。请设计一个实验证明这一结论: 。
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系。回答下列问题: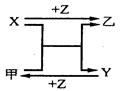
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的气态化合物分子, Y基态原子的轨道表示式为 ,甲的电子式为
(2)若X原子的价电子排布为ns(n-1)np(n+2),常温下Y为易挥发的液体物质、乙为无色易溶于水的气体。则Z为 ,组成Y的元素的基态原子的电子排布式为 。
(3)若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为: ,Y2+离子的电子排布式为 。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号