2014年化学高考总复习课时演练 11-4化学实验方案设计与评价练习卷
下列有关化学实验的叙述正确的是( )
| A.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后呈红色 |
| B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| C.用稀盐酸洗涤盛放过石灰水的试剂瓶 |
| D.欲配制质量分数为10%的ZnSO4溶液,应将10 g ZnSO4·7H2O 溶解在90 g水中 |
化学实验中常将某些溶液或试剂进行酸化或碱化。下列处理中正确的是( )
| A.检验KClO3中的氯元素,可加入AgNO3和稀硝酸 |
| B.为提高KMnO4溶液的氧化能力,用浓盐酸将KMnO4溶液酸化 |
| C.检验蔗糖在稀硫酸中水解产生的葡萄糖,应先用NaOH溶液碱化后才能进一步检验 |
| D.检验溶液中是否含有SO42-时,先加氯化钡溶液后,再加稀盐酸酸化 |
下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质: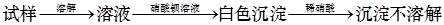 |
B.除去乙酸乙酯中混有的乙酸: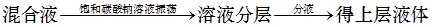 |
C.证明酸性条件下H2O2氧化性比I2强: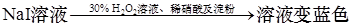 |
D.鉴定盐A的成分是FeBr2: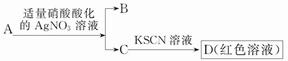 |
检验下列物质中是否含有杂质(括号内为杂质),检验方法及除杂试剂均正确的是( )
| 物质及其杂质 |
检验 |
除杂 |
| A.Cl2(HCl) |
湿润的淀粉KI试纸 |
饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) |
Ca(OH)2溶液 |
过量CO2 |
| C.CO2(HCl) |
AgNO3溶液(含稀硝酸) |
饱和Na2CO3溶液 |
| D.NO(NO2) |
观察颜色或湿润的淀粉KI试纸 |
水 |
下列有关实验操作、现象和解释或结 论都正确的是( )
| |
操 作 |
现 象 |
解释、结论 |
| A |
过量的Fe粉中加入硝酸充分反应,滴入KSCN溶液 |
溶液呈红色 |
稀硝酸将Fe氧化为Fe3+ |
| B |
AgI沉淀中滴入稀KCl溶液 |
有白色沉淀出现 |
AgCl比AgI更难溶 |
| C |
Al箔插入稀硝酸中 |
无现象 |
Al箔表面被硝酸氧化,形成致密的氧化膜 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
下列实验操作正确的是( )
| A.粗盐提纯时,为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 |
| B.滴定管洗净后无需烘干,只要经待装液润洗2~3次,即可注入待装液进行滴定 |
| C.把新制的氯水滴在pH试纸上测其pH |
| D.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
某同学想用实验证明高锰酸钾的紫红色是MnO4-的颜色,而不是K+的颜色,他设计了以下实验方案。请你判断下列方案与本实验目的无关的是( )
| A.观察氯化钾溶液没有颜色,表明溶液中的K+无色 |
| B.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应 |
| C.在高锰酸钾溶液中加入适量锌粉、振荡、静置后紫红色褪去,表明MnO4-为紫红色 |
| D.将高锰酸钾晶体加热分解,所得的固体质量减轻 |
下列实验设计能够成功的是( )
| |
实验目的 |
实验操作 |
| A |
该物质一定是氨气 |
该物质的水溶液能使红色石蕊试纸变蓝 |
| B |
除去硫酸钠溶液中少量氯化钠杂质 |
向含有氯化钠杂质的硫酸钠溶液中加入适量的硝酸银溶液,过滤 |
| C |
该溶液一定含有大量碳酸根离子 |
某物质的水溶液中加入盐酸产生无色无味气体 |
| D |
浓硝酸的氧化性强于稀硝酸 |
向盛有少量的浓硝酸、稀硝酸的两支试管中,分别加入大小相同的铜片 |
下列有关实验原理或实验操作正确的是( )
| A.用干燥pH试纸测定某新制氯水的pH |
| B.用图1装置除去乙烷中混有的乙烯 |
| C.用图2装置能验证HCl气体在水中的溶解性 |
| D.用25 mL碱式滴定管量取20.00 mL KMnO4溶液 |
用下列实验或实验装置进行的实验中,能达到相应实验目的的是( )
| A.装置甲:防止铁钉生锈 |
| B.测定同温同浓度的NaCl和NaF溶液的pH,确定F、Cl两元素的非金属性的强弱 |
| C.装置乙:除去乙烷中混有的乙烯 |
| D.用Ca(OH)2溶液来鉴别Na2CO3溶液和NaHCO3溶液 |
亚硫酸钠中的+4价硫,既有氧化性,又有还原性。现有试剂:溴水、Na2S溶液、 Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究。填写下列空白。
【探究一】实验方案:铝镁合金 测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol·L-1 NaOH溶液中,充分反应。NaOH溶液的体积V≥______。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”或“偏低”)。
【探究二】实验方案:铝镁合金 测定生成气体的体积实验装置:
测定生成气体的体积实验装置:
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是:_____(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______________________________。
②______________________________。
【探究三】
实验方案:称量x g铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:
(1)欲计算镁的质量分数,该实验中还需测定的数据是______。
(2)若用空气(不考虑CO2)代替O2进行实验,对测定结果有何影响? _____(填“偏高”、“偏低”或“无影响”)。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=IO3-+5I-+3H2O;KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液后显红色,该红色物质是_____________(用化学式表示);CCl4中显紫红色的物质是___________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为_______________________________________、__________________________________________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?___________ (填“是”或“否”),并说明理由_________________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_______。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+____________________________________________________________________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号