[湖北]2014届湖北省黄冈市黄州区部分学校九年级11月联考化学试卷
下列物质变化过程中,包含了化学变化的是( )
| A.铁丝编成铁网 | B.冰块制成冰雕 | C.葡萄酿成酒 | D.木板制成桌椅 |
下列实验操作中正确的是( )
| A.向试管中滴加液体时,滴管应垂悬在试管口上方,并不接触试管 |
| B.实验用剩的药品应放回原试剂瓶中 |
| C.加热后的试管应立即用冷水冲洗 |
| D.为了便于观察,给试管里的液体加热时试管口应对着自己 |
下列有关水的描述中不正确的是 ( )
| A.电解水时在正极产生氧气 |
| B.水是由氢原子和氧原子构成的 |
| C.可用肥皂水来区分硬水和软水 |
| D.在沉淀、过滤、蒸馏等净化水的操作中,净化程度最高的是蒸馏 |
如图装置常用来测定空气中氧气的含量。下列对该实验的认识中正确的是 ( )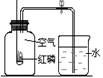
| A.红磷燃烧产生大量白色烟雾 |
| B.燃烧匙中的红磷可以换成细铁丝 |
| C.该实验可说明N2难溶于水 |
| D.红磷的量不足会导致进入集气瓶中水的体积大于1/5 |
下列有关氧气的叙述正确的是( )
| A.铁丝在氧气中燃烧,发出耀眼的白光,生成黑色固体 |
| B.空气中氧气含量的测定实验中,可以将红磷换成木炭 |
| C.给氯酸钾加热,若不加催化剂也能产生氧气 |
| D.氧气的化学性质比较活泼,是可燃物 |
下列说法正确的是( )
| A.只含有一种元素的物质一定是纯净物 |
| B.含氧元素的物质一定是化合物 |
| C.混合物一定由不同种分子构成 |
| D.化合物中一定含有不同种元素 |
实验室常用二氧化锰与浓盐酸反应制取氯气,反应的化学方程式为:
MnO2+4HCI(浓)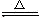 MnCl2+2X+Cl2↑,其中X的化学式为( )
MnCl2+2X+Cl2↑,其中X的化学式为( )
| A.H2O | B.H2O2 | C.HClO | D.O2 |
在2013年一本化学资料的学习工具卡上有常见的化合价记忆口诀,有一句是“SO42﹣、CO3 2﹣ 负二价,NO3﹣、OH﹣负一价,还有NH4+正一价”,请问NH4+中氮元素的化合价是( )
| A.+3 | B.+1 | C.-3 | D.+5 |
下列化学符号中数字表示的意义正确的是 ( )
| A.S2- :“2–”表示硫元素的化合价为负二价 |
| B.2Na:“2”表示两个钠元素 |
C. :“+2”表示镁离子带有两个单位正电荷 :“+2”表示镁离子带有两个单位正电荷 |
| D.CO2:“2”表示一个二氧化碳分子含有两个氧原子 |
2013年3月底,上海、安徽等地出现H7N9新型流感病毒,严重威胁人们健康,其治疗有效药物达菲可用莽草酸(C7H10O5)制取。有关莽草酸的说法正确的是( )
| A.莽草酸中氢元素的质量分数最大 |
| B.莽草酸由碳、氢、氧三种元素组成 |
| C.莽草酸中各元素的质量比为7:10:5 |
| D.莽草酸的相对分子质量为170 |
某氧化物RO2中含氧元素的质量分数为50%,则该化合物的相对分子质量为( )
| A.64 | B.16 | C.32 | D.80 |
在化学反应2A+B2=2AB中,A与B2反应的质量关系如图所示,现将6gA和8gB2充分反应,则生成AB的质量是( )
| A.9g | B.11g | C.12g | D.14g |
用化学用语填空:
(1)镁 ;
(2)2个氮气分子 ;
(3)5个硫酸根离子 ;
(4)碳酸氢铵 ;
(5)氢氧化铝中铝元素显+3价 ;
(6)由Fe 3+和OH— 构成的氢氧化铁 。
我们学习了氧气的化学性质和制取。请运用你所学氧气的知识完成下列化学方程式的书写:
(1)有白色固体生成的化合反应 ;
(2)有黑色固体生成的化合反应 ;
(3)实验室用液体物质制取氧气 ;
(4)某气体燃烧生成水 。
今年世界水日的宣传主题───水和粮食安全。某校环保小组的同学响应这一主题,对右江河水进行检测。
①近几年右江河上捞沙船越来越多,造成河水非常浑浊。除去水样中难溶性杂质应进行的操作是 (填字母);
A.过滤 B.结晶 C.蒸发
②为了保护右江河的水质,下列做法合理的是 (填字母);
A.禁用农药和化肥 B. 抑制水中所有动、植物生长
C.任意排放生活污水 D. 工业废水经过净化后再排放
③在日常生活中,如果水的硬度大或者病原微生物过多,都可以采取 的方法来降低水的硬度和杀灭病原微生物。
化学的学科特征是在分子和原子水平上研究物质和创造物质。下图中A、B、C、D是四种粒子的结构示意图。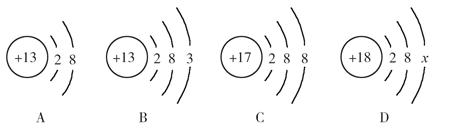
请回答下列问题:
(1)图中A、B、C、D粒子共表示 种元素。
(2)A、B、C、D中表示的阳离子与阴离子所形成的化合物的化学式为 。
(3)D中x = 。
现有A、B、C、D、E、五种物质.A为白色固体,B、C都是黑色固体,将A、B混合加热时产生无色气体E;且反应前后B的质量和化学性质都不改变。C在E中剧烈燃烧发生白光,生成无色气体D,D能使澄清的石灰水变浑浊。根据上述变化回答:
(1)写出有关物质的化学式:
A: ; B: ; E: ;
(2)写出下列变化的化学方程式:
①C+E→D:
②A→E:
在实验室里加热30g氯酸钾(KClO3)和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g。请计算:
(1)生成氧气的质量为 g; (2)原混合物中氯酸钾的质量。
下图所示为实验室中常见的气体制备和收集装置。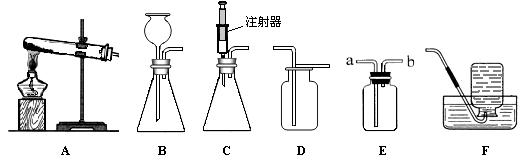
请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用发生装置 (填字母序号),反应的化学方程式为 。若用装置D收集氧气,验满的方法是 。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C的优点是 。
(3)欲使用装置E用排空气法收集氢气,则气体应从 (填“a”或“b”)端通入;欲使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从 (填“a”或“b”)端通入。
(4)已知一氧化氮气体难溶于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置 (填字母序号)。
在化学反应前后,物质的总质量会发生变化吗?针对此问题,小王同学通过下面的实验进行探究。
[猜想假设]猜想1:化学反应前后物质的总质量增大;猜想2:化学反应前后物质的总质量 ;猜想3:化学反应前后物质的总质量 。
[设计实验]到底哪种猜想正确?小王想设计了下面的实验进行探究。
实验:用热的玻璃棒点燃白磷,使其燃烧,测定反应前后物质的质量变化。
[实验现象]白磷燃烧产生 ;气球先变大,后又变小.天平最后仍平衡。
[实验反思](1)实验中气球先变大,后又变小的原因是 。
小王根据该实验现象,再结合前面所学的碳酸钙和盐酸反应前后的质量变化情况的实验探究得出了下列结论:当用有气体参加或生成的化学反应来验证质量守恒定律时,应在 ,才能判定参加化学反应的反应物总质量和生成物总质量是否相等。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号